
[헬스코리아뉴스 / 이충만] 유전자를 자유자재로 편집하여 질환을 치료할 수 있는 CRISPR 유전자 편집 기반 약물이 차세대 혈액 질환 치료제로 주목을 받고 있다.
시장조사 전문업체 글로벌 데이터(Global Data)에 따르면, 지난 5년간 CRISPR 유전자 편집 기술에 대한 라이선스 거래 비용은 2020년 56억 달러, 2022년 158억 달러, 2023년 40억 달러로 총 254억 달러(한화 약 32조 2000억 원)에 달했다.
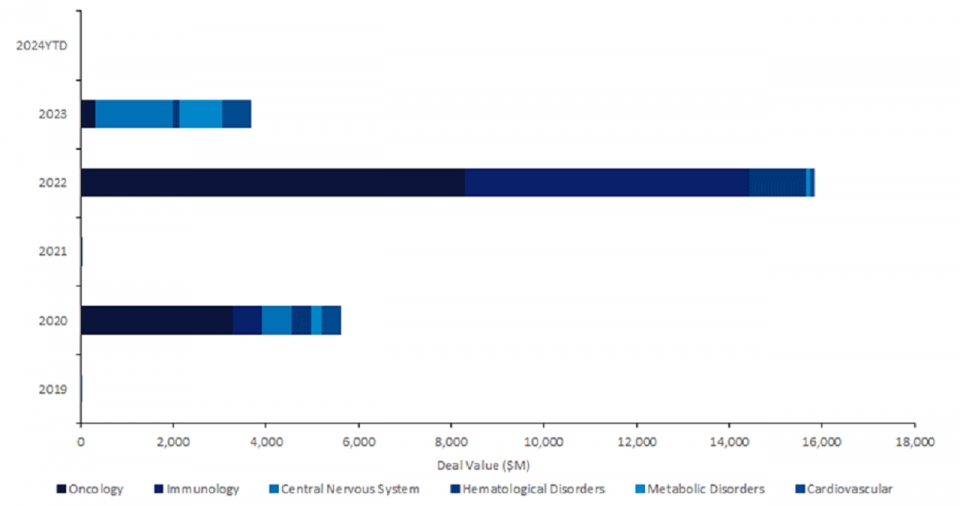
눈에 띄는 점은, 2022년 혈액 질환 치료제에 대한 거래가 2020년 대비 폭증하여 항암제 거래에 이어 두번째로 높은 비중을 차지한 것이다.
이와 관련 글로벌 데이터는 “혈액 질환 치료 분야에서 CRISPR 유전자 편집 기술은 점점 더 중요한 역할을 담당할 것”이라며 “향후 많은 CRISPR 유전자 편집 혈액 질환 치료제가 등장할 것”이라고 전망했다.
실제로, 가장 먼저 허가를 취득한 CRISPR 유전자 편집 치료제는 혈액 질환 약물이다. 미국 식품의약국(FDA)은 2023년 12월, ‘카스거비’(Casgevy, 성분명: 엑사감글로진 오토템셀·exagamglogene autotemcel)를 겸상 적혈구병(SCD) 치료제로 허가한 바 있다. [아래 관련기사 참조]
SCD는 적혈구의 모양이 낫 모양으로 변형되어 산소 결합력이 감소하고 혈류에 영향을 주는 질환으로, 낫모양 적혈구빈혈증이라고도 불린다. 그간 SCD에 대한 뚜렷한 치료제는 없었고, 환자는 빈혈 증상을 해결하기 위해 정기적인 수혈을 받아야 했다.
‘카스거비’는 SCD를 1회 투약으로 완치하도록 설계된 유전자 편집 치료제다. 환자의 조혈모세포를 채집하여 높은 수준의 태아형 헤모글로빈(HbF) 생성을 촉진하도록 DNA를 편집하고, 다시 환자에게 주입한다.
태아형 헤모글로빈은 일반적인 헤모글로빈 대비 산소와 더 강하게 결합하여 자궁 내 태아 발달에 기여한다. 출생 12개월 이후 태아형 헤모글로빈은 BCL11A 유전자로 인해 생성이 중단되는데, ‘카스거비’는 BCL11A 유전자의 활성을 차단하여 HbF 생성을 유도하고, 이를 통해 SCD를 치료하는 기전이다.
혈액 질환 분야 관심 부상 중
CRISPR 유전자 편집 기술이 혈액 질환 분야에서 주목을 받고 있는 이유는 혈액 질환의 고유한 특징에서 기인한 것으로 보인다. 혈액 질환은 혈액 내에서 발생하거나 혈액 세포와 밀접한 관련이 있는 경우가 많은데, 이는 CRISPR 유전자 편집 치료제가 특정한 유전자를 표적하는 데 더욱 용이하게 작용하도록 한다.
이에 따라 제약·바이오 기업들의 CRISPR 유전자 편집 치료제에 대한 관심은 혈액 질환까지 넓혀지는 분위기다. 대표적으로 프랑스 사노피(Sanofi)는 미국 바이오 벤처 기업인 스크라이브 테라퓨틱스(Scribe Therapeutics)와 CRISPR 유전자 편집 관련 맺었던 협력 계약의 범위를 확대한 바 있다.
구체적으로 살펴보면, 사노피는 지난 2022년 9월, 스크라이브 테라퓨틱스와 CRISPR 유전자 편집 기술에 기반한 자연살해(NK) 세포 치료제(항암제) 개발에 대한 약 10억 달러 규모의 라이선스 기술 계약을 체결한 바 있다.
이듬해 7월 양사는 해당 라이선스 기술 계약의 범위를 SCD에 대한 치료제 개발까지 확장했다. 자연스럽게 사노피의 추가 라이선스 인 비용도 약 12억 달러, 총합 22억 달러 규모로 늘어났다.
CRISPR 유전자 편집 치료제, 접근성 개선 필요
CRISPR 유전자 편집 치료제의 관심이 혈액 질환까지 확대됨에도 불구하고, CRISPR 유전자 편집 치료제의 ‘억’ 소리나는 약가는 일반 서민들에게 그림의 떡과 같은 존재다. 가령, ‘카스거비’의 비용은 미국 기준 220만 달러(한화 약 29억 원)에 달한다.
이는 기업이 CRISPR 유전자 편집 기술을 발명하기 위해 천문학적인 금액을 투입한 만큼, 투자한 자원과 노력에 대한 합리적인 수익을 기대할 수 있도록 독점적인 지적 재산권을 부여하기 때문이다.
일부 정부지원 학술기관은 제약·바이오 기업에 의존하지 않고 조금 더 저렴한 CRISPR 유전자 편집 치료제를 직접 개발하려는 시도를 하고 있다.
하지만, 대량생산이 불가능한 제한적인 유전자 치료제 제조 역량과 업체들이 독점하고 있는 지적 재산권과의 충돌 문제로 인해 성공 가능성은 극히 낮은 것으로 보인다.
따라서 CRISPR 유전자 편집 치료제의 환자 접근성을 높이기 위해서는 CRISPR 유전자 편집 치료제에 대한 독점 지적 재산권의 유연한 해석과 자동화를 통한 CRISPR 유전자 편집 치료제의 제조 여건 개선이 필요하다는 지적이 나온다.
헬스코리아뉴스(hkn24.com) 이충만 admin@hkn24.com 2024.04.02 00:01