흑색종·폐암 이어 유방암까지…‘암백신’ 개발 적응증 어디까지 확대되나
- 모더나·MSD 등 mRNA 기반 항암백신 임상 중…다양한 암종 확대 기대감
- 암백신, 암 재발률 낮추는 병용요법 연구 활발
- 모더나·바이오엔테크·큐어백 임상 속도…韓 제넥신·애스톤사이언스 성과
[더바이오 성재준 기자] 차세대 항암제로 불리는 면역항암제에 이어 환자 개인의 면역체계를 이용해 암세포를 인식하고 공격하도록 유도하는 맞춤형 ‘암백신’ 개발이 활발하다. 맞춤형 암백신의 목표 치료 분야도 흑색종 등 일부 암에서 시작했지만, 최근에는 폐암, 유방암 등 다양한 암종으로 목표 적응증이 확대되고 있어 관심이 쏠린다.
맞춤형 암백신은 환자 개개인의 암 항원을 면역세포가 인지하도록 해 암 예방과 치료를 목표로 한다. 종양미세환경을 조절해 면역세포의 효과를 높이고, 면역관문억제제와 병용 시 효과가 증대될 수 있다. 최근 연구에 따르면, 단독요법보다는 면역세포를 활성화해 종양세포를 공격하는 면역항암제와의 병용 투여가 암 재발률을 낮출 것으로 기대된다.
◇모더나·MSD·바이오엔테크 등 mRNA 기반 신항원 치료제 임상 평가 중
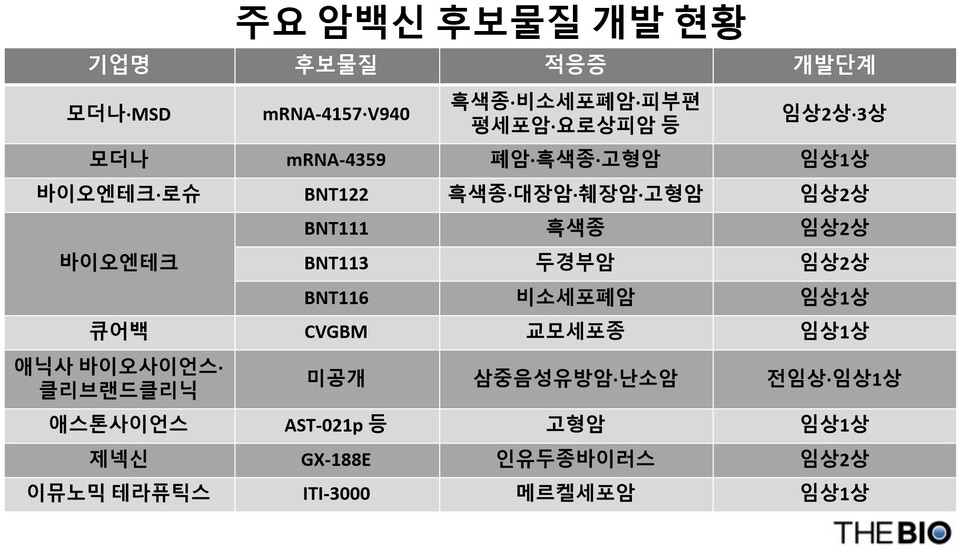
15일 업계에 따르면 최근 글로벌 제약사들이 암백신 개발에 속도를 내면서, 다양한 종류의 암에 대응하는 백신 후보물질들이 임상 단계에서 평가되고 있다.
암백신 병용요법 개발에 가장 적극적인 곳은 미국 모더나(Moderna)와 다국적 제약사 MSD(미국 머크)다. 양사가 개발하고 있는 ‘mRNA-4157(V940)’이 대표적이다. 이 치료제 후보물질은 메신저 리보핵산(mRNA) 기술을 이용해 최대 34개에 이르는 암세포의 특정 항원을 인식해 항암 T세포 반응을 활성화하도록 만들어진 ‘개별화 신항원 치료제(INT)’다.
두 기업은 현재 모더나의 mRNA-4157과 MSD의 면역항암제인 ‘키트루다(kyetruda, 펨브롤리주맙)’ 병용요법으로 △절제 가능한 2, 3A 또는 3B기 비소세포폐암(NSCLC) 임상3상 △절제된 고위험성 2B~4기 흑색종 임상3상 △절제 가능한 진행성 2~4기 피부편평세포암 임상2·3상 △신장암 및 근육 침윤성 요로상피암 임상2상 등을 진행하고 있다. 특히 mRNA-4157은 임상 후기 단계에 있어 향후 최초로 승인받는 암백신이 될 가능성이 크다.
모더나와 함께 자체 mRNA 플랫폼을 보유하고 있는 독일 바이오엔테크(BioNTech)는 NSCLC, 흑색종 그리고 두경부암을 대상으로 ‘BNT116(이하 개발코드명)’, ‘BNT111’, ‘BNT122’ 그리고 ‘BNT113’ 등 4가지 암백신 후보물질을 갖고 있다.
독일 mRNA 기업인 큐어백(CureVac)도 암백신 후보물질인 ‘CVGBM’을 개발하고 있다. CVGBM은 큐어백의 2세대 mRNA 백본을 기반으로 교모세포종 관련 항원을 표적하는 에피토프를 포함한 단일 융합 단백질을 암호화해 교모세포종 환자에게 면역반응을 유도하는 첫 번째 임상시험용 암백신이다.
최근 미국 휴스턴에서 열린 제39회 미국면역항암학회(SITC 2024)에서 미국 클리브랜드클리닉(Cleveland Clinic)과 애닉사바이오사이언스(Anixa Biosciences)는 삼중음성유방암(TNBC) 예방 백신 후보물질에 대한 임상1상 결과를 발표했다. 해당 후보물질은 대부분의 환자에서 면역반응을 유도하고, 부작용이 적은 것으로 나타났다. 양측은 이번 연구 결과를 바탕으로 현재 고위험 환자를 대상으로 진행 중인 임상1상을 마친 후 2025년부터 임상2상 연구로 확대할 예정이다.
◇국내서도 애스톤사이언스·제넥신, AACR·해외 학술지 통해 암백신 성과 공개
국내에선 제넥신과 애스톤사이언스가 암백신을 개발하고 있다. 애스톤사이언스는 지난 4월 미국암연구학회 연례학술대회(AACR 2024)에서 암백신 후보물질인 ‘AST-021p(개발코드명)’의 임상1상(CornerStone-002) 결과 등 6건의 연구 결과를 공개했다.
제넥신은 7월 인유두종바이러스(HPV) DNA 항암백신 후보물질인 ‘GX-188E(성분 티발리모진 테라플라스미드)’와 키트루다 병용요법 임상2상 결과를 해외 학술지인 ‘클리니컬메디신 인터넷판(eClinicalMedicine)’에 게재했다.
HLB(에이치엘비)의 미국 자회사인 이뮤노믹테라퓨틱스(Immunomic Therapeutics, 이하 이뮤노믹)는 지난해 10월 희귀 피부암인 메르켈세포암(MCC) 환자를 대상으로 미국에서 진행한 ‘ITI-3000’의 임상1상에서 안전성과 효능을 확인했다.
ITI-3000은 이뮤노믹의 세포 치료 백신 플랫폼인 ‘UNITE’를 기반으로 MCC를 유발하는 폴리오마 바이러스의 거대 T항원(Large T antigen)의 돌연변이형 염기서열을 ‘LAMP1(lysosomal-associated membrane protein)’ 유전자 염기서열과 결합해 만든 항암 치료 백신 후보물질이다. 2022년 11월 미국 식품의약국(FDA)으로부터 ‘패스트트랙’ 약물로 지정받았다.
더바이오 성재준 기자 입력 2024.11.15 06:20