최적의 뇌종양 수술 위치, 반응성 별세포 영상으로 찾는다
뇌세포의 절반 이상을 구성하는 별 모양의 비신경세포인 별세포는 알츠하이머나 염증 등에 의해 세포의 수와 크기가 증가한 ‘반응성 별세포’로 활성화한다. 반응성 별세포는 다양한 뇌병변에서 관찰되며, 뇌종양도 예외는 아니다. 가장 흔하지만 환자의 치료 예후가 나쁜 악성 종양으로 알려진 교모세포종의 주변부에서도 반응성 별세포가 발현하지만, 종양세포와 반응성 별세포 간 대사 기전은 명확히 알려지지 않았다.
기초과학연구원(IBS, 원장 노도영) 인지 및 사회성 연구단 이창준 단장 연구팀은 세브란스병원(원장 하종원) 핵의학과 윤미진 교수팀, 신경외과 강석구・장종희 교수 연구팀과 함께 뇌종양 환자의 종양 주변부에 발현하는 반응성 별세포의 대사 매개 물질인 아세트산의 항진을 영상화하는 기술을 제안했다. 그리고 이 기술로 종양 미세환경의 에너지 대사 기전을 밝혀 새로운 뇌종양 치료 가능성을 확인했다.
교모세포종은 종양과 그 주변부의 반응성 별세포를 비롯한 다양한 종류의 세포들과 함께 종양 미세환경(Tumor microenvironment)을 형성하는 특징을 갖는다. 종양 미세환경을 구성하는 다양한 요소들은 상호 작용을 통해 종양의 진행, 종양세포의 전이, 치료 반응과 효과에 지대한 영향을 미치는 것으로 알려져 있다.
연구진은 뇌종양의 종양 미세환경까지도 영상화할 수 있는 기술로 탄소11-아세트산(11C-acetate)을 활용한 양전자 방출 단층 촬영(Positron Emission Tomography, PET)을 제안했다. 11C-acetate는 아세트산을 흡수하는 세포를 영상화하는 방사성추적자로, PET는 이 방사성추적자가 방출하는 양전자를 측정해 영상으로 시각화한다. 종양세포에서 아세트산을 과다 흡수한다고 알려져 기존에도 암 진단에 사용됐다.
그러나 이번 연구에서 교모세포종 환자에서 유래한 종양 조직 이식 동물모델로 종양 미세환경을 영상화하여 분석한 결과, 아세트산이 종양세포보다는 주변에 형성된 종양 미세환경, 특히 반응성 별세포에 의해 대부분 흡수되는 것을 밝혀냈다.
종양세포는 계속 분열하기 위해 기본 에너지원이 되는 포도당을 거의 독점하다시피 이용해 빠른 에너지 대사 과정을 거친다. 그리고 이러한 대사 과정의 부산물로 아세트산을 생성해 배출했다. 이렇게 생성된 아세트산은 별세포에서 특이적으로 발현하는 모노카복실산 수송체1(Monocarboxylate transporter 1, MCT1)에 의해 흡수되고, 과도하게 흡수된 아세트산이 반응성 별세포화를 유도하는 것을 확인했다. 반대로, 반응성 별세포화나 MCT1의 발현을 억제하면 종양 미세환경의 아세트산 대사가 정상적으로 회복됐다.
또한, 연구진은 뇌종양 환자에서 11C-acetate PET 촬영으로 확인된 종양 미세환경 부위(아세트산 과다흡수 부위)가 MRI로 촬영된 종양 부위에 비해 클수록 환자의 치료 예후가 좋지 않음을 발견했다. 일반적으로 뇌종양의 치료는 MRI로 구분된 종양을 수술로 절제하여 제거하는 방식으로 이루어졌으나, 이러한 결과는 뇌종양 치료를 위해 종양 미세환경의 제거가 중요함을 보여준다. 특히, 종양의 진행과 전이에 중요한 역할을 하는 반응성 별세포와 종양 줄기세포 부분을 외과적 수술로 절제하는 것이 성공적인 치료에 핵심임을 시사한다.
윤미진 세브란스병원 교수는 “11C-acetate PET 영상은 뇌종양을 진단하고 수술 절제 부위를 결정하는 데 효과적으로 활용될 수 있다”라며, “종양 미세환경을 구분하여 제거할 수 있다면, 종양의 재발을 막아 환자의 예후가 훨씬 좋을 것”이라고 말했다. 또한, “11C-acetate PET와 같은 분자 영상 기술은 질병의 진단과 동시에 치료를 수행하는 신개념의 진단․치료 기술인 ‘테라노스틱스(Theranostics)’가 될 수 있다는 데 의의가 있다”라고 전했다.
이창준 IBS 단장은 “다양한 뇌병변에서 나타나는 반응성 별세포화의 기전을 이해하면 뇌질환 극복을 앞당길 수 있을 것”이라며, “이번 연구로 종양 미세환경에서 나타나는 반응성 별세포화가 에너지 대사의 결과로 유도됨을 새롭게 규명했다”라고 밝혔다. 이어“종양세포와 함께 종양 미세환경을 구성하는 반응성 별세포, 종양 줄기세포, 주변 신경세포 등이 서로 어떻게 영향을 주고받는지 살펴보는 후속 연구가 필요하다”라고 전했다.
이번 연구결과는 세계적인 신경종양학회지인 ‘뉴로-온콜로지(Neuro-Oncology)’에 지난해 12월 12일 온라인 게재됐다.
논문/저널/저자
Visualizing cancer-originating acetate uptake through monocarboxylate transporter 1 in reactive astrocytes in the glioblastoma tumor microenvironment / Neuro-oncology / 2023
Dongwoo Kim, Hae Young Ko, Jee-In Chung, Yongmin Mason Park, Sangwon Lee, Seon Yoo Kim, Jisu Kim, Joong-Hyun Chun, Kyung-Seok Han, Misu Lee, Yeon Ha Ju, Sun Jun Park, Ki Duk Park, Min-Ho Nam, Se Hoon Kim, Jin-Kyoung Shim, Youngjoo Park, Hyunkeong Lim, Jaekyung Park, Hyunjin Kim, Gwan-Ho Lee, Suhyun Kim, Uiyeol Park, Kwan-Ho Lee, Hoon Ryu, So Yun Lee, Sunghyouk Park, Seok-Gu Kang, Jong Hee Chang, C. Justin Lee, Mijin Yun
연구내용 보충설명
이번 연구는 11C-acetate를 프로브로 활용한 PET 영상이 뇌종양 환자의 뇌 속 반응성 별세포화를 동반한 종양 미세환경을 시각화하였다는 점에서 임상적 의의를 갖는다. 종양세포 주변의 별세포가 어떻게 반응성 별세포화되어 종양 미세환경을 이루는지 기전을 보여주고 있어 병리학적 측면에서도 의의가 있다.
이번 연구는 11C-acetate PET에 의해 나타나는 종양 주변부 아세트산 과다흡수 범위가 MRI로 규정된 종양 범위에 비해 넓다는 것을 발견하면서 시작되었다. 일반적으로 종양세포에서 11C-acetate의 추적물질인 아세트산을 흡수한다는 것이 잘 알려져 있기에, 뇌종양 환자에서 마찬가지로 11C-acetate PET에 의해 나타나는 아세트산 과다흡수가 종양세포 때문으로 생각해왔다. 그러나 종양으로 규정된 범위보다 넓은 범위에서 아세트산 과다흡수가 나타나는 사실과 연구진이 2023년 상반기 알츠하이머 환자의 반응성 별세포 영상화에 11C-acetate PET을 활용한 경험을 고려하여 통념과는 다른 가설을 세우게 되었다. 즉, 뇌종양 환자에서 11C-acetate PET에 의해 나타나는 아세트산 과다흡수가 종양세포에 의한 것인지, 주변부 반응성 별세포에 의한 것인지에 대한 검증을 하고자 하였다.
연구의 핵심은 주된 아세트산 흡수가 종양세포가 아닌 반응성 별세포에서 일어난다는 사실이다. 오히려 종양세포는 에너지 대사를 통해 아세트산을 합성하고 분비하는 역할을 하였다. 이렇게 분비된 아세트산이 종양 주변의 별세포에 흡수되는데, 종양세포의 과도한 에너지 대사의 결과로 생성된 과량의 아세트산이 주변 별세포를 반응성 별세포화시킨다는 것이 본 연구에서 밝힌 기전이다. 이번 연구는 종양 미세환경 내 종양세포와 반응성 별세포의 세포 간 상호작용을 에너지 대사 측면에서 살펴보았다는 점에서 병리학적 의의를 갖는다.
또한 11C-acetate PET에 의해 나타나는 종양 주변부 아세트산 과다흡수 범위가 MRI로 규정된 종양 범위에 비해 넓으면 넓을수록 환자의 예후가 좋지 않았던 임상적 결과는 종양 외에 종양 미세환경을 구성하는 다른 세포들의 역할이 뇌종양의 진행과 치료에 핵심적일 수 있음을 보여준다. 이번 연구에서는 종양 미세환경 내 종양 줄기세포와 반응성 별세포의 존재가 좋지 않은 환자의 예후를 설명할 수 있을 것이라 제시하였다.
연구 이야기
[연구 과정]
교모세포종 환자의 종양세포와 주변부에 나타난 반응성 별세포화의 기전을 밝히기 위해 에너지 대사 측면에 초점을 맞춰 연구를 진행하였다. 기초와 임상을 포함한 중개의학적 연구를 위해, 동물모델에서의 microPET imaging과 자기방사법(autoradiography), 면역조직염색(Immunohistochemistry), 전사체학(Transcriptomics) 등 다각적인 실험 기법을 활용하였다. 또한, 두 방식의 교모세포종 동물 모델(U87MG 세포주 주입 모델, 환자 유래 교모세포종 이종 이식 모델; Patient-derived xenograft model)과 사후 환자 뇌 샘플을 활용하였다.
연구진은 지난 알츠하이머 연구에서와 마찬가지로 아세트산이 모노카복실산 수송체1 (MCT1)을 통해 반응성 별세포 특이적으로 흡수되는 것을 증명하였다. 아세트산 섭취의 증가는 반응성 별세포 형성과 관련이 있었으며, 이 아세트산은 종양세포의 포도당 대사 결과로 생성되는 것임을 밝혔다.
나아가, 교모세포종 환자의 11C-acetate PET 영상을 통해 나타난 아세트산 이상 과다흡수 부위가 MRI로 규정된 종양 부위보다 크면 클수록 무진행 생존기간(PFS)과 전체 생존기간(OS)이 현격히 감소한 것을 발견하였다. 이에 대한 원인은 여러 가지가 있을 수 있지만, 이번 연구에서는 종양 미세환경 내 존재하는 종양 줄기세포의 존재가 그 원인 중 하나일 것이라 지적하였다.
[어려웠던 점]
이번 연구는 기존의 통념을 깨는 연구였다. 다른 수많은 암에서 그렇듯, 뇌종양도 종양세포에서 아세트산의 과다흡수가 일어나는 것으로 여겨졌다. 그러나 이번 연구에서 종양세포가 아닌 주변의 반응성 별세포에서 아세트산을 과다 흡수하는 것을 밝혀냈지만, 이를 설득하는데 어려움이 있었다.
또한 이번 연구에서 활용된 뇌종양 동물 모델이 실제 뇌종양 환자의 양상과 다른 부분도 큰 어려움이었다. 처음에 사용한 종양세포 세포주(U87MG cell line) 주입 모델이 실제 환자의 사후조직과 달라 동물모델을 신뢰하기 어려웠기 때문에, 실제 환자의 양상과 유사하도록, 뇌종양 환자 유래 조직을 이종 이식한 동물모델을 제작하여 실험을 진행하였다.
마지막으로, 연구결과의 임상적 의미를 확인하기 위해 통계적으로 유의미한 임상 데이터의 확보가 중요한데, 이를 위해서는 많은 수의 대조군과 실험군이 필요하였다. 그리고 PET 영상 촬영을 위해 많은 피험자의 적극적인 참여가 필수이므로 상당한 물적, 인적자원이 요구되었다.
[성과 차별점]
이번 연구에서 제안한 11C-acetate PET 영상 기술은 종양세포를 넘어 종양 미세환경을 시각화함으로써 더욱 정확하게 뇌종양 진행에 대한 진단을 가능케 할 것이다. 또한, 종양 미세환경의 시각화는 기존의 MRI 기반으로 종양을 절제했던 수술의 방식을 혁신적으로 변화시킬 것이다. 종양의 전이와 진행에 매우 핵심적인 종양 줄기세포를 포함하고 있는 종양 미세환경을 시각화해 정확히 제거할 수 있다면 수술 이후 훨씬 좋은 예후를 기대할 수 있을 것이다.
무엇보다 이번 연구는 종양 미세환경 내 종양세포와 반응성 별세포의 세포 간 상호작용을 에너지 대사 측면에서 살펴보았다는 점에서 병리학적 의의를 가지며, 기존 종양 미세환경에서의 아세트산 흡수에 대한 통념을 깬 것에 큰 차별점이 있다고 할 수 있다.
[향후 연구계획]
반응성 별세포는 종양 미세환경 뿐만 아니라 다른 뇌질환에서도 그렇듯, 주변의 신경세포에 해로운 영향을 끼칠 것으로 예상한다. 향후 후속 연구를 통해, 종양 주변 별세포가 반응성 별세포화됨에 따라 주변 신경세포에 어떠한 영향을 끼치는지 살펴보고자 한다.

교모세포종 환자의 뇌 속 종양 및 주변부에서는 아세트산 이상 과다 흡수가 나타난다. 종양세포의 포도당을 이용한 에너지 대사의 결과로 생성되는 아세트산이 주변의 별세포에 분비되어 MCT1을 통해 흡수된다. 이상 과다흡수된 아세트산은 MAO-B 발현 증가를 동반한 반응성 별세포화를 유도한다.

붉은 점선으로 표시된 교모세포종(고위험군) 환자의 종양 부위 부근에서 11C-아세트산 흡수가 증가하였으며(붉은색), MRI로 확인된 종양 크기에 비해 큰 것을 확인했다. 성상세포종(저위험군)에서는 11C-아세트산 흡수 증가를 관찰할 수 없었다.
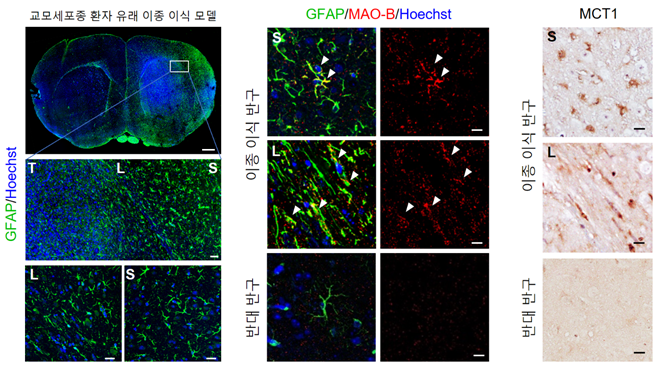
교모세포종 환자의 종양 조직을 마우스에 이종 이식한 뇌종양 동물 모델 속 이종 이식 반구에서 반응성 별세포화의 표징인 GFAP과 MAO-B의 증가 및 별세포 특이적인 아세트산 수송체인 MCT1 발현의 증가를 확인하였다. 조직을 이식하지 않은 반대 반구에서는 GFAP과 MAO-B, MCT1 의 발현이 현저히 적었다.

검정색 점선으로 표시된 영역 중, 조직이 이식된 부분(Peri-T)에서 11C-아세트산 흡수가 증가하고(붉은색), 반응성 별세포화의 표징인 GFAP과 MAO-B의 증가 및 별세포 특이적인 아세트산 수송체인 MCT1 발현의 증가를 확인하였다. 이러한 변화는 마오비(MAO-B) 억제제(KDS2010)로 반응성 별세포화를 억제하거나(위), MCT1 유전자의 발현을 억제할 경우(아래) 정상 수준으로 회복됐다.

교모세포종 환자의 아세트산 과다섭취 부위는 종양 미세환경을 반영하기에 MRI로 규정된 종양 부위보다 크다. 그러나 이 두 부피의 차이가 클수록(아세트산 과다섭취 부위의 크키가 클수록) 무진행 생존기간과 전체 생존기간 모두 급격히 감소한 것을 발견했다.
본 기사는 네티즌에 의해 작성되었거나 기관에서 작성된 보도자료로, BRIC의 입장이 아님을 밝힙니다. 또한 내용 중 개인에게 중요하다고 생각되는 부분은 사실확인을 꼭 하시기 바랍니다.
BRIC(ibric.org) Bio통신원(기초과학연구원) 등록일2024.01.16