[임상약리학자와 Project Optimus] 항암제 임상시험 개요 및 한계

그림 1에 소개한 책은 인간이 암 치료법 개발을 위해 어떤 역사가 있었는지 다룬다. 근현대에 들어서는 항암제 임상시험이 정치인과 로비스트, 제약업계, 의료인, 과학자들에 의해 어떤 발자취를 걸었는지도 상세하게 다룬다. 필자는 근무지 센터장님께 책을 선물 받아 아주 재미있게 읽었기 때문에 항암제 임상연구를 하시는 제약업계 종사자들에게도 이 책을 강력히 권한다.
이번 연재에서는 US FDA Oncology Center of Excellence (OCE)에서 시작한 Project Optimus를 소개하고자 한다. Project Optimus는 항암제 개발의 용량 최적화 및 용량 선택 패러다임을 개혁하기 위한 이니셔티브이다. 첫 번째 글에서는 항암제 임상시험의 개요와 현시점에서의 한계점을 이야기한다. 두 번째에서는 Project Optimus 그 자체에 대해 소개하고, 마지막 세 번째 글에서는 Project Optimus로부터 파생되어 나온 연구들을 소개하고자 한다. 본 연재가 국내 항암제 임상시험의 이해관계자들에게 조금이라도 Project Optimus라는 글로벌 트렌드와 익숙해지는 데 도움이 되었으면 한다.
1971년 “War on Cancer (암과의 전쟁)”이 시작된 이래로 연구자들과 제약업계는 암을 퇴치하기 위해 끊임없이 노력해 왔다. 항암제 임상시험 실패의 원인에는 생체 내 종양 미세 환경을 정확하게 반영하지 못하는 2차원 세포 배양 시스템도 있다. 이를 해결하기 위해 신뢰성이 높은 고속대량독성스크리닝 기능이 가능한 생리학적 체외 모델에 대한 요구가 증가하고 있다. 또한 오픈 액세스 환경에서 신약 개발 노력을 가속화하기 위해 암 치료를 위한 화합물의 식별 및 개발을 지원하기 위해 EU-OPENSCREEN과 같은 이니셔티브로 설립되었다. 이러한 발전은 항암제 임상시험의 지속적인 발전과 암 치료의 효능과 안전성을 개선하기 위한 공동의 노력을 보여준다.
항암제 임상시험 대상자 특성
전통적인 항암제 임상시험 대상자는 일반적으로 표준 치료 옵션을 모두 사용한 진행성 악성 종양 환자이다. 이러한 환자는 예후가 좋지 않은 경우가 많고, 실험적 치료법을 시도할 의향이 있는 경우가 많다. 예를 들어, 전이성 비소세포폐암 환자를 대상으로 한 연구에 따르면 대상 환자의 32%가 최소 한 가지 이상의 임상시험에 등록했으며, 대부분이 1/2상 임상시험에 참여한 것으로 나타났다.
항암제 임상시험의 일반적인 시험 설계
일반적으로 의약품 임상시험은 세 단계로 구분되지만, 항암제 임상시험의 절차는 일반 의약품의 임상시험과는 다르게 진행된다. 항암제 임상시험의 첫 번째 단계는 용량 결정을 목적으로 하고, 두 번째 단계는 약의 효과성을 평가하며, 세 번째 단계는 임상적 유익성을 확인하는 과정이다.
제1상 임상시험에서는 암 치료 가능성이 있는 신약을 처음으로 인간 대상에게 적용하면서, 낮은 용량에서 시작해 약물의 독성이 관찰되지 않는 범위 내에서 점차 용량을 늘려가며 최대내성용량(maximum tolerated dose, MTD)과 용량제한독성(dose limiting toxicity, DLT)을 파악하고, 약물의 임상약리학적 특성을 규명한다. 이를 통해 제2상 시험의 용량과 투여 방법을 결정한다. 그림 2는 전통적인 3+3 디자인 방식으로 이 단계의 일반적인 접근 방식을 보여준다.
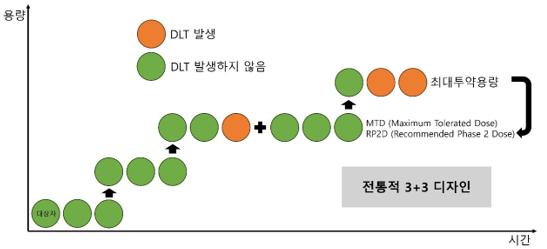
제2상 임상시험은 제1상에서 정해진 최대 허용 용량의 75-90% 또는 권장되는 2상 시험 용량(recommended phase 2 dose, RP2D)을 사용하여, 특정 암종에서 약의 효과를 평가하고 이를 토대로 진행 여부를 결정하는 단계이다. 마지막으로, 제3상 임상시험은 앞선 단계의 결과에 기반하여 약물의 임상적 가치를 최종적으로 평가한다.
전통적 항암제 임상시험의 한계
지금까지 설명한 전통적인 항암제 임상시험의 가장 큰 한계는 항암제 대부분이 “결과적으로는” MTD 이하에서도 충분한 약효를 보임에도 불구하고, 1상에서 MTD를 알기 위해 임상시험 대상자에게 이상반응이 나타나야 한다는 것이다. 이에 대한 윤리성이 지속적으로 의문시되어 왔다. 2016년 Desamparados Roda 등이 Clinical Cancer Research (American Association for Cancer Research 저널 중 하나)에 아래 제목의 Perspectives를 게재하였다. (그림 3)

이들은 2002년 1월부터 2015년 2월까지 FDA에서 승인된 34개의 저분자 표적항암제의 안전성 프로파일을 체계적으로 검토하였다. 제3상 임상시험에서 Small molecule-molecularly targeted agent (SM-MTA)로 치료받은 환자 중 45%가 약물 관련 독성(drug-related toxicity)으로 인해 용량 조절이 필요하였으나, 이러한 독성은 단 9%에서만 약물 중단(drug discontinuation)과 관련이 있었다. 전반적으로 약동약력학 데이터에 근거하여 SM-MTA의 25%가 RP2D를 MTD 이하로 선정하였으며, 이렇게 RP2D가 선정된 임상시험들은 MTD를 기반으로 2상 용량을 선정했던 임상시험과 비교하여 용량 변경 횟수가 유의하게 적었다.
위 연구 외에도 다수 연구와 경험을 바탕으로, MTD 파악을 목적으로 항암제 제1상 임상시험을 하는 것은 득 보다 실이 크다고 판단되었다. 이에 FDA는 Project Optimus를 개시하였다. 2024년 2월 15, 16일 양일간 FDA와 AACR (American Association for Cancer Research)는 public workshop을 개최하여 항암제 개발 시 용량 최적화에 대해 정보를 전달하면서 Project Optimus의 의의를 공고히 하였다. 동영상과 발표 자료가 홈페이지(https://www.aacr.org/professionals/policy-and-advocacy/regulatory-science-and-policy/events/fda-aacr-workshop-optimizing-dosages-for-oncology-drug-products/)에 오픈되어 있다.
다음 연재에서는 Project Optimus 자체에 대해 자세히 소개한다.
참고문헌
-식품의약품안전처, 항암제 임상시험 가이드라인[민원인 안내서], 2019.09.
-Farooq MA, Aquib M, Farooq A, Haleem Khan D, Joelle Maviah MB, Sied Filli M, Kesse S, Boakye-Yiadom KO, Mavlyanova R, Parveen A, Wang B. Recent progress in nanotechnology-based novel drug delivery systems in designing of cisplatin for cancer therapy: an overview. Artificial cells, nanomedicine, and biotechnology. 2019 Dec 4;47(1):1674-92.
- Jo Y, Choi N, Kim K, Koo HJ, Choi J, Kim HN. Chemoresistance of cancer cells: requirements of tumor microenvironment-mimicking in vitro models in anti-cancer drug development. Theranostics. 2018;8(19):5259.
- Stechmann B, Wit C. EU-OPENSCREEN-An open-access initiative in chemical biology to support anti-cancer drug discovery. Cancer Research. 2023 Apr 4;83(7_Supplement):5319-.
- Merkhofer C, Eaton KD, Martins RG, Ramsey SD, Goulart BH. Potential impact of clinical trial (CT) participation on survival of patients with metastatic non-small cell lung cancer (NSCLC).
- 박인숙, 김동섭, 최기환, 왕소영, 임화경, 오우용, 김소희, 강주희, 방영주, 김주일. 국내 항암제의 임상현황 및 항암제 임상시험 가이드라인. 임상약리학회지. 2002;10(2):165-72.
- FDA-AACR Public Workshop On OPTIMIZING DOSAGES FOR ONCOLOGY DRUG PRODUCTS: QUANTITATIVE APPROACHES TO SELECT DOSAGES FOR CLINICAL TRIALS (https://www.aacr.org/professionals/policy-and-advocacy/regulatory-science-and-policy/events/fda-aacr-workshop-optimizing-dosages-for-oncology-drug-products/)
- Roda D, Jimenez B, Banerji U. Are doses and schedules of small-molecule targeted anticancer drugs recommended by phase I studies realistic?. Clinical Cancer Research. 2016 May 1;22(9):2127-32.
본 기사는 네티즌에 의해 작성되었거나 기관에서 작성된 보도자료로, BRIC의 입장이 아님을 밝힙니다. 또한 내용 중 개인에게 중요하다고 생각되는 부분은 사실확인을 꼭 하시기 바랍니다.
BRIC(ibric.org) Bio통신원(선우정) 등록일2024.04.04