인간 미토콘드리아 DNA의 아데닌 염기교정 기술 최초 개발
기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(전(前)단장 김진수)은 세계 최초로 미토콘드리아 DNA의 아데닌(A) 염기 교정 도구인 ‘TALED(Transcription Activator-Like Effector-linked Deaminase)’를 개발하여 Cell에 발표하였다. 미토콘드리아 유전질환 연구와 치료제 개발에 널리 활용될 것으로 기대된다.
미토콘드리아는 에너지를 만들어내는 세포 내 소기관이다. 미토콘드리아 DNA에 변이가 일어나면 5,000명 중 한 명 꼴로 발생하는 심각한 유전질환 뿐 아니라 암·당뇨병·노화 관련 질환을 일으킬 수 있다. 병원성 미토콘드리아 DNA의 돌연변이 95개 중 90개는 DNA 염기 하나가 변이된‘점 돌연변이’다. 점 돌연변이를 원래의 염기로 교정하면 대부분의 병원성 미토콘드리아 유전질환을 치료할 수 있다. 그러나 최근까지 미토콘드리아 DNA 교정은 불가했다. 2020년 미토콘드리아 DNA의 시토신(C) 염기를 티민(T)으로 교정하는 기술이 개발됐지만, 점 돌연변이 9개(10%)만 고칠 수 있다는 한계가 있었다.
IBS 연구진은 미토콘드리아에서 아데닌(A) 염기를 교정하는 기술을 최초로 개발하였다. 이는 점 돌연변이 39개(43%)를 고칠 수 있어, 미토콘드리아 DNA의 표적 범위를 비약적으로 늘렸다. 이로써 미토콘드리아 관련 다양한 종류의 동물 질환 모델 제작 및 미토콘드리아 유전질환의 근본적인 치료 길을 열었다.
1저자인 조성익 연구원은 세균에서 유래한 ‘DddA 시토신 탈아미노 효소’에 주목했다. 기존의 탈아미노 효소는 DNA 단일 가닥에 작동하는 반면 DddA는 이중가닥에 작동한다. 연구진은 DddA가 DNA 이중가닥을 일시적으로 풀어 탈아미노효소를 DNA 이중 가닥에 접근할 수 있게 하리라는 가설을 세웠다. 이에 DddA와 아데닌 탈아미노 효소(TadA 8e)를 융합한 염기 교정 기술인 TALED를 제작했다. TALED를 인간 미토콘드리아 DNA에 적용한 실험 결과, 아데닌이 탈아민화되며 구아닌으로 치환됐다. 인간 미토콘드리아 DNA의 아데닌 염기 교정에 최초로 성공한 것이다.
나아가 시토신 탈아민화 효율을 높이는 UGI(Uracil-DNA glycosylase inhibitor) 단백질을 TALED에 융합하면 시토신과 아데닌의 염기 교정을 동시에 일으킬 수 있음을 확인했다. UGI가 없으면 시토신 염기교정은 일어나지 않고 아데닌 염기만 교정되었다. 시토신과 아데닌의 동시 교정은 원하는 유전자의 무작위 돌연변이 유발에, 아데닌 염기의 선택적 교정은 질병 치료 또는 질병 모델 제작에 사용될 수 있다. 미토콘드리아 DNA를 교정하는 유용한 도구 2가지를 개발한 것이다. 연구진은 총 17개의 미토콘드리아 DNA 내 표적 염기서열에 대해 TALED를 만들어 검증하였으며, 최대 49%에 달하는 높은 아데닌 교정 효율을 보여주었다.
교신저자인 김진수 전 단장은 “마땅한 치료법이 없었던 미토콘드리아 유전질환의 근본적인 해결책을 제시했다”며 “TALED는 다른 세포소기관인 엽록체에서도 작동 가능해 식물에도 적용할 수 있는 만큼, 분자생물학과 유전학 뿐 아니라 바이오제약·생명공학·농림수산업·환경 산업에도 폭넓게 기여할 것이다”라고 전했다.
이번 연구결과는 생물학 분야의 권위 있는 학술지인 셀(Cell, IF 41.582)에 4월 26일 게재되었다.
연 구 추 가 설 명
논문/저널/저자
Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases / Cell(2022)
(조성익(제1저자/서울대학교/기초과학연구원),이성현(기초과학연구원),목영근(기초과학연구원),임가영(기초과학연구원),이재석(서울대학교/기초과학연구원),이지민(서울대학교/기초과학연구원),정유진(서울대학교/기초과학연구원),김진수(교신저자/기초과학연구원)
연구내용 보충설명
DddA 시토신 탈아미노효소는 그 자체로 쓰면 세포에서 독성을 유발한다. 따라서 독성이 없는 형태로 사용해야 한다. 독성이 없는 형태로는 둘로 쪼개진 ‘split DddA’와 시토신 탈아민 활성을 없앤 ‘전장 DddA(E1347A)’가 있다. 즉 TALED는 3가지 형태가 있다. (그림2 참조)
1) DddA 시토신 탈아미노 효소가 둘로 쪼개져 있는 sTALED (Split TALED)
대표적인 TALED로서 평균 효율이 가장 높다. 미토콘드리아 DNA 표적을 사이로 왼쪽과 오른쪽 각각에 붙을 수 있는 DNA 결합단백질 TALE이 필요하며, 해당 TALE에 쪼개진 DddA가 각각 붙는다. 아데닌 탈아미노효소는 한쪽에만 붙는다.
2) 활성이 없는 전장 DddA(E1347A) 시토신 탈아미노효소와 아데닌 탈아미노효소가 하나의 DNA 결합 단백질 TALE에 융합된 mTALED (Monomeric TALED)
미토콘드리아 DNA를 표적할 때 하나의 TALE만 디자인하며 단일 모듈로 작동한다는 장점이 있다. 이는 대부분의 치료제 벡터로 사용하는 AAV에 경우 큰 장점을 갖는다. AAV 바이러스 벡터는 탑재할 수 있는 용량이 제한적인데, 하나의 모듈로만 사용하는 mTALED는 하나의 AAV 벡터에 탑재할 수 있기 때문이다.
한편 sTALED에 비해 off-targegt이 적다는 장점도 있다.
3) 활성이 없는 전장 DddA(E1347A) 시토신 탈아미노효소와 아데닌 탈아미노효소가 서로 다른 두 개의 DNA 결합 단백질 TALE에 융합된 dTALED (Dimeric TALED)
sTALED처럼 두 개의 서로 다른 TALE에 융합되어진 형태다. sTAELD에 비해 off-target이 적다.
활성이 없는 전장 DddA(E1347A) 시토신 탈아미노효소는 시토신을 탈아민화하는 활성은 없어졌지만, 아데닌 탈아미노효소가 DNA 이중가닥에 접근하도록 하는 능력은 유지하고 있기 때문에 아데닌 염기 교정이 일어남을 확인 할 수 있었다. 또한 sTALED, mTALED그리고 dTALED 모두 표적하는 미토콘드리아 DNA에서 일으키는 아데닌 염기교정의 패턴이 다르다. 따라서 3가지 기술 모두 경우에 따라 알맞게 활용할 수 있을 것이다.
연구 이야기
[어려웠던 점]
TALE 기반 융합단백질을 제작하는 것은 CRISPR 시스템과 달리 과정이 훨씬 복잡하다. 이번 연구에서 표적한 미토콘드리아 DNA는 17곳이나 되기에 3가지 종류의 TALED를 각각에 맞게 디자인 하는 과정이 까다로웠다.
[향후 연구계획]
동물, 식물 모델에서 TALED system을 이용한 연구가 진행 될 수 있으며, TALED system을 더욱 개량하는 연구가 진행 될 수 있을 것이다.
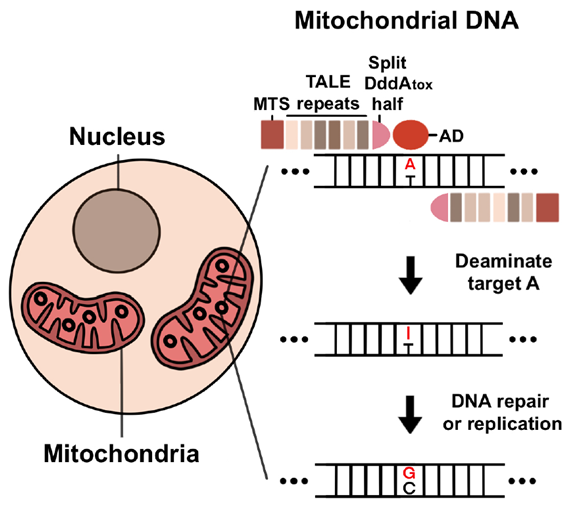
[그림1] 미토콘드리아 DNA에서 TALED의 아데닌 염기 교정 모식도
미토콘드리아(mitochondria) 내부로 전달된 TALED가 아데닌(A)의 탈아민화 반응을 일으켜 이노신(I)으로 바꾼다. 이후 DNA 수선 과정 또는 복제 과정을 거쳐 최종적으로 구아닌(G)로 치환되게 된다.

[그림 2] 3가지 TALED의 구조
TALED는 3가지 형태를 가진다.
1. DddA 단백질이 쪼개져서 사용되는 sTALED
2. 활성없는 전장 DddA와 모든 구성요소가 하나의 TALE에 있는 mTALED
3. 활성없는 전장 DddA와 아데닌 탈아민 효소가 각각 다른 TALE에 있는 dTALED

[그림 3] 여러 미토콘드리아 DNA 표적에서의 아데닌 염기 교정 효율
TALED는 여러 미토콘드리아 DNA 표적에서 높은 효율로 아데닌 교정효율을 일으킨다. sTALED 경우 평균 27 ± 3% 효율을, mTALED와 dTALED 경우 평균 19± 4%을 보였다. 가장 높은 평균 효율을 보여준 것은 sTALED로, 최대 49%의 효율을 기록했다.
생명과학 기초과학연구원 (2022-04-26)