슈퍼컴퓨터를 통한 가상실험으로 단백질에 의한 DNA 뭉침-풀림 조절 원리 규명
DGIST 에너지공학전공 장윤희 교수‧프랑스 투르대 이브란삭 교수(DGIST 겸직교수) 공동연구팀은 슈퍼컴퓨터를 활용해 단백질에 의해 조절되는 DNA 뭉침-풀림 현상을 분자 수준에서 관찰했다. 이러한 가상실험은 기존 실험 연구의 대안으로 생체 내 여러 현상을 원천적으로 이해하는데 큰 도움이 될 것으로 기대된다.
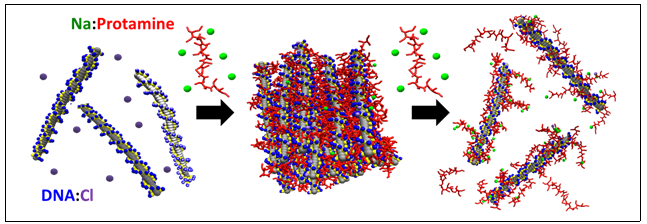
생체 유전 정보를 담고 있는 DNA는 음전하를 띠고 있어 서로 밀어내는 힘이 강함에도 불구하고 강하게 뭉쳐 세포핵 내 작은 공간에 자리한다. 게다가 생식세포 내에서는 프로타민(protamine)이라는 작은 단백질에 의해 더욱 강하게 뭉쳐 유전 정보를 안전하게 보호하고 원활하게 전달한 후 다시 풀어진다. 하지만 생명의 근원에 해당하는 이 신비로운 현상을 실제 실험을 통해 분자 수준에서 관측하기는 어렵다.
이에 장윤희 교수‧이브란삭 교수 공동연구팀은 슈퍼컴퓨터를 활용한 대규모 분자동력학 가상실험을 수행하여 프로타민 단백질에 의해 조절되는 DNA 뭉침-풀림 현상을 분자 수준에서 관측했다. 그 결과 양전하를 띠는 염기성 단백질인 프로타민과 음전하를 띠는 DNA 사이의 상대적 농도에 따라 DNA의 뭉침과 풀림이 가역적(可逆的)으로 조절된다는 것을 발견했다. 이는 아무리 복잡한 생명 현상이라도 그 근원에는 정전기적 상호작용이 지배적으로 작용함을 확인한 것이다. 이를 확장해 자기복제, 유전 등의 근원적 생명 현상을 원천적으로 이해하는데 기여할 것으로 기대된다.
DGIST 에너지공학전공 장윤희 교수는 “단백질과 DNA/RNA의 응축물 형성이 수많은 생리 기능을 조절한다는 증거가 속속 나오고 있어, 향후 관련 연구를 수행하는데 이번 연구의 결과와 방법을 활용될 가능성이 높을 것으로 기대된다”고 말했다. 이어“프로타민은 DNA 응축 뿐 아니라 RNA 자기조립에서도 가역적 접착제 역할을 하는 분자이므로, 이번 연구를 확장해 mRNA 백신 개발 및 생체 모사 에너지 전환 기술 개발에도 기여하고 싶다”는 포부를 밝혔다.
한편, 이번 연구는 과학기술정보통신부‧한국연구재단 중견연구자사업의 지원을 통해 수행됐으며, DGIST와 프랑스 투르대학 간에 도입한 국제공동박사학위제의 성과다. 연구 결과는 ‘ACS Nano’에 8월 24일 정식 출판됐다.
연 구 결 과 개 요
Protamine-Controlled Reversible DNA Packaging: A Molecular Glue(https://pubs.acs.org/doi/10.1021/acsnano.1c02337)
Arnab Mukherjee, Ambroise de Izarra, Jeril Degrouard, Enrick Olive, Prabal K. Maiti, Yun Hee Jang, Yves Lansac
ACS Nano, 15 (8), 13094-13104 (2021)
생식세포 내 DNA 유전자는 백만 배까지 응축되어 좁은 세포핵에 수용된다. 이러한 고도의 응축은 아르기닌이 풍부한 작은 염기성 단백질인 프로타민에 의해 조절되는 것으로 알려졌지만 그 기작은 명확하지 않다. 실험적 관측이 힘든 이 동적 기작을 분자 수준에서 관측하고 이해하기 위해, 단순한 분자 모델과 정전기적 상호작용을 토대로 대규모 분자동력학 모사를 수행하였다. 프로타민 대 DNA 비율에 따라 DNA 응축과 해리의 가역적 조절이 가능함을 보였고, 예측된 결과와 구조는 실험적 상분포도, 극저온투과전자현미경 결과와 일치한다. 본 연구에서 재현한 DNA-프로타민 복합체 응축은 액체-액체 상분리 현상의 일종으로서, 이러한 상분리 또는 구획화가 생식세포 형성 또는 기능에 어떤 역할을 하는지에 대한 연구로 확장될 수 있다. 또한, 최근 개발 노력이 집중되고 있는 mRNA 백신의 패키징에 중요한 접착제 역할을 하는 물질로서 프로타민 또는 그 유사체가 거론된다. 본 연구의 대상 물질을 DNA에서 mRNA로 확장함으로써, 효과적인 백신 개발을 위한 구성 요소 분자 설계 원리를 제공할 수 있을 것으로 기대된다.
연 구 결 과 문 답
이번 성과 무엇이 다른가
DNA 응축-해리는 자기복제, 번식, 유전자 보호 등을 위해 세포 내에서 정밀하게 반복되는 기작으로서 생명의 근원에 해당한다. 실험적 관측이 어려운 이 동적 기작을 분자 수준에서 관측하고 이해하기 위해, 슈퍼컴퓨터를 활용한 분자동력학 모사를 수행하였다. DNA의 각 염기쌍, 단백질의 각 아미노산을 단순하게 표현한 분자 수준 모델과 이들 간 정전기적 상호작용을 도입한 대규모 모사로부터, 양전하를 띠는 생식세포 내 프로타민 단백질의 농도에 따라 음전하를 띠는 DNA의 응축-해리가 가역적으로 조절됨을 보였고, 예측된 구조의 일부는 극저온투과전자현미경 실험으로 확인되었다. 이렇듯 전산모사/가상실험 연구는 아직 많은 한계를 보이는 실험 연구의 대안으로 다양한 현상의 원천적 이해를 돕는 역할을 한다.
어디에 쓸 수 있나
본 연구에서 모사한 프로타민 기반 DNA 응축은 액체-액체 상분리의 일종으로서, 세포막 없는 세포 내 소기관 (membraneless organelle) 형성에 의한 세포 기능 수행의 이해를 돕는 데 본 연구가 활용될 수 있다. 또한, 본 연구의 대상을 DNA에서 mRNA로 확장하여, 가역적 mRNA 응축-해리조절 기작을 찾아 효과적이고 안전한 mRNA 백신 개발에 기여할 수 있다.
실용화까지 필요한 시간과 과제는
본 연구는 실제 시스템의 핵심 요소만을 추출하여 기술하는 기초 모델 연구로서, 단기 실용화보다는 중장기 미래 기술 개발에 활용될 핵심 원리 제시에 주력한다.
연구를 시작한 계기는
DNA는 자연계에서 가장 길고 뻣뻣한 분자 중 하나이고 음전하를 띠고 있지만, 강하게 뭉쳐 세포핵 내 작은 공간에 자리하며 자기분열 시 또는 생식세포 내에서는 더욱 강하게 뭉쳤다가 다시 풀어지는 정밀한 동적 기작을 거친다는 점이 매우 신기했다. 이에 대한 이해와 모사는 생명의 근원에 한발 더 가까워지게 해줄 뿐 아니라, 의약-소재-에너지 분야로의 응용을 가능하게 해줄 것이라고 생각했다.
어떤 의미가 있는가
양전하를 띠는 염기성 단백질인 프로타민과 음전하를 띠는 DNA 사이의 상대적 농도에 따라 DNA의 응축과 해리가 가역적으로 조절됨을, 단순한 모델의 분자 수준 대규모 분자동력학 모사 (coarse-grained molecular dynamics simulation) 통해 보임으로써, 걷잡을 수 없이 복잡한 생명 현상이라도 그 근원에서 정전기적 상호작용이 지배적으로 작용함을 확인하였다. 즉, 급속히 발전하는 슈퍼컴퓨팅-네트워킹 기술을 활용한 분자 수준 전산모사로 생명 현상의 원천적 이해가 가능할 것임을 시사한다.
꼭 이루고 싶은 목표는
본 연구에서 살펴본 프로타민 농도 외에도 프로타민 전하, NaCl 농도 등이 DNA 자기조립 조절 인자가 될 수 있으므로 그 영향을 살필 것이며, 이들을 조절하는 보다 근원적인 기작 및 에너지원을 찾고자 한다. 이렇게화학 에너지가 기계적 에너지로 전환되는 정밀 기작을 이해함으로써 생체 모사 에너지 전환 연구와 연관 짓고 싶다.

생명과학 DGIST (2021-08-31)