새로운 세포 청소부, 뇌 속 별세포가 알츠하이머 치매 치료 가능성 높인다
한국과학기술연구원(KIST, 원장 오상록) 뇌질환극복연구단 류훈 박사 연구팀은 기초과학연구원(IBS, 원장 노도영) 이창준 단장 연구팀, 보스톤 의대 이정희 교수 연구팀과 공동으로 별세포(Astrocyte)를 활용해 알츠하이머 치매 치료 메커니즘을 규명하고 새로운 치료 표적을 제시했다. 공동 연구진은 이번 연구를 통해 뇌 속 비신경세포인 별세포의 자가포식(Autophagy, 오토파지) 작용이 알츠하이머 치매 환자 뇌 속에서 아밀로이드 베타(Aβ) 올리고머 독성 단백질을 제거하고 기억력과 인지 능력을 회복하는 것을 밝혔다.
노인성 치매의 대표적인 사례로 알려진 알츠하이머 치매는 아밀로이드 베타(Aβ)와 같은 독성 단백질이 뇌 안에서 비정상적으로 응집 및 축적되면서 염증 반응과 신경세포의 손상을 유발해 나타나는 퇴행성 뇌 질환이다. 지금까지 학계에서는 별세포가 신경세포 주변의 독성 단백질을 제거하는 것에 주목했으나 그 과정은 명확히 규명되지 않았다.
오토파지란 세포 스스로(Auto)가 잡아먹는(Phagy) ‘자가포식’ 과정이다. 연구팀이 세포의 항상성을 유지하는 별세포의 자가포식 작용에 주목한 결과, 알츠하이머 환자의 뇌에서 독성 단백질 축적이나 뇌 염증 반응 발생 시 별세포가 자가포식 작용을 조절하는 유전자를 유도해 대응하고 있음을 관찰했다. 이를 바탕으로 별세포에만 선택적으로 발현하는 자가포식 유전자를 알츠하이머가 유도된 쥐의 뇌에 주입해 손상된 신경세포가 회복되는 과정을 확인했다.
연구팀은 별세포의 자가포식 작용이 아밀로이드 베타(Aβ) 단백질 덩어리를 줄이며 동시에 기억력과 인지 기능을 함께 개선할 수 있다는 사실을 입증했다. 특히, 뇌의 기억을 저장하는 해마 부위에서 자가포식 조절 유전자 발현이 증가할 경우, 뇌 조직 내 병리 현상이 줄어드는 사실도 확인했다. 무엇보다 알츠하이머 치매의 주원인으로 알려진 아밀로이드 베타(Aβ) 올리고머 독성 단백질 제거에 별세포의 자가포식 기능이 활용될 수 있음을 입증함으로써 알츠하이머 치매 치료의 가능성을 제시했다.
이번 연구는 알츠하이머 치료제 개발을 위해 진행된 신경세포 중심 접근법에서 벗어나 비신경세포인 별세포를 새로운 알츠하이머 치매 치료제의 표적으로 제시한 점에서 큰 의의를 지닌다. 연구진은 별세포의 자가포식 기능을 강화해 치매 증상을 예방하거나 완화할 수 있는 약물을 탐색하고 이에 대한 전임상 연구를 진행할 계획이라고 밝혔다.
KIST 류훈 박사는 “별세포의 자가포식 기능에 따라서 신경세포의 손상이 조절되고 또한 치매 뇌에서는 인지 기능 또한 조절됨을 밝혔다”라며, “자가포식과 관련된 세포 생물학적 기전 이해를 증진하고 세포 내 노폐물 제거 및 세포 건강 유지에 관한 기초 연구의 발전을 기대한다”라고 밝혔다.
본 연구는 과학기술정보통신부(장관 유상임)의 지원을 받아 KIST 주요사업 및 중견연구자지원사업(2022R1A2C3013138), 보건복지부(장관 조규홍)의 치매극복과제(RS-2023-KH137130)으로 수행됐다. 이번 연구 성과는 국제 학술지 「Molecular Neurodegeneration」 (IF 14.9, JCR 분야 2.1%)에 최신 호에 게재됐다.
□ 논문
○ 제목: Astrocytic autophagy plasticity modulates Aβ clearance and cognitivefunction in Alzheimer’s disease
○ 학술지: Molecular Neurodegeneration
○ 게재일: 2024.07.23.
○ DOI: https://doi.org/10.1186/s13024-024-00740-w
□ 저자
○ 김수현 박사후연구원 (공동제1저자/ KIST 뇌과학연구소)
○ 전희정 교수 (공동제1저자/ 연세대)
○ 류 훈 책임연구원 (공동교신저자/ KIST 뇌과학연구소)
○ 이창준 단장 (공동교신저자/ IBS 인지 및 사회성연구단)
○ 이정희 교수 (공동교신저자/ 보스턴 의대 알츠하이머치매연구센터)
○ 연구배경
알츠하이머성 치매(Alzheimer’s disease: AD)는 주로 아밀로이드 베타 (Aβ) 올리고머와 같은 독성 단백질의 축적으로 인한 신경세포의 손상을 시작으로 신경 염증 반응 및 산화 스트레스 증가와 같은 복합적인 과정의 상호작용으로 병리가 진행된다. 이 과정에서 별세포가 신경세포 주변의 독성 단백질의 제거를 통해서 뇌를 보호하는 기능은 정확하게 밝혀져 있지 않다. 이 연구는 알츠하이머병에서 가장 두드러진 병리 현상인 아밀로이드 베타 (Aβ) 독성 단백질이 어떻게 치매를 일으키는 지와 별세포의 자가포식 기능이 아밀로이드 베타 올리고머 독성 단백질의 제거를 통해 기억력 및 인지기능을 어떻게 유지하는 지를 밝히고자 하였다.
○ 연구내용
본 연구는 아밀로이드 베타 (Aβ) 올리고머가 별세포의 자가포식을 조절하는 유전자 (LC3B, SQSTM1) 발현을 유도함을 확인하였다. 이 자가포식 조절 유전자 발현의 감소는 뇌조직 내에 아밀로이드 베타 축적의 증가를 일으킬 수 있고,신경 세포의 독성의 증가와 기억력 감소 및 인지기능 장애를 가속화 시킴을 치매동물모델에서 확인하였다. 이와 반대로 자가포식 조절 유전자의 별세포 특이적인 과발현을 통해서 아밀로이드 베타 축적의 감소와 인지기능 장애의 회복을 확인하였다. 또한, 본 연구에서는 별세포 특이적인 자가포식 조절 유전자의 억제는 미토콘드리아 기능의 장애와 별세포 내에 산화 스트레스를 증가 시킴을 확인하였다. 흥미롭게도 알츠하이머병 환자의 뇌조직에서 별세포에서 자가포식 조절 유전자의 발현 증가를 확인하였다. 이 연구결과는 기존의 신경세포의 중심의 알츠하이머병의 치료 접근법을 벗어나, 별세포에 의한 자가포식 기능 강화를 통한 아밀로이드 베타의 제거 효과를 통해 뇌 기능의 보호 효과를 가져 올 수 있는 가능성을 제시하였다.
○ 기대효과
본 연구는 세계 최초로 알츠하이머성 치매 환자 뇌 안의 스트레스 상황에서 별세포가 자가포식 조절유전자 (LC3B, SQSTM1)를 유도하고 있음을 밝혔다. 이어서 별세포는 자가포식 작용을 통해 아밀로이드 베타를 효과적으로 제거함으로써 기억력과 인지 기능을 향상시킴을 치매 동물 모델에서 밝혔다. 이 발견은 기존의 신경세포 중심 접근법에서 벗어나, 별세포의 자가포식 기능 강화를 통한 알츠하이머 치매의 새로운 치료 타겟의 가능성을 제시한다.
연구결과 문답
□ 연구를 시작한 계기나 배경은?
알츠하이머성 치매(Alzheimer’s disease: AD)는 전세계적으로 환자가 증가하고 있는 치명적인 퇴행성 뇌질환인 치매의 한 종류이다. 국내의 65세 이상 노인 인구의 약 10.3%가 치매를 앓고 있는 것으로 추정된다. 알츠하이머병은 주로 아밀로이드 베타 (Aβ) 올리고머와 같은 독성 단백질의 축적으로 인한 신경세포의 손상을 시작으로 신경 염증 반응 및 산화 스트레스 증가와 같은 복합적인 과정의 상호작용으로 병리가 진행된다. 이 퇴행성 뇌 손상 과정에서 별세포는 신경세포 주변의 독성 단백질의 제거를 통해서 뇌 손상을 줄이려고 하는데 이 과정에 대한 기전은 아직까지 정확하게 밝혀져 있지 않다. 따라서 별세포에서 일어나는 자가 포식 (Autophagy)작용 (세포내에서 거대 단백질/지방 분자와 같은 찌꺼기를 제거하는 현상)이 아밀로이드 베타 (Aβ) 올리고머를 제거 할 것으로 추측하고 이의 조절 기전에 대한 명확한 이해를 위해 연구를 진행하였다. 또한 이러한 별세포의 자가포식 작용이 치매증상의 조절 및 완화에 작용하는지도 증명 하고자 하였다.
□ 이번 성과, 무엇이 다른가?
본 연구는 세계 최초로 알츠하이머성 치매 환자 뇌 안의 스트레스 상황에서 별세포가 자가포식 조절유전자를 유도하고 있음을 발견하였다. 이어서 별세포는 자가포식 작용을 통해 아밀로이드 베타를 효과적으로 제거함으로써 기억력과 인지 기능을 향상시킴을 치매 동물 모델에서 밝혔다. 이 발견은 기존의 신경세포 중심 접근법에서 벗어나, 별세포의 자가포식 기능 강화를 통한 알츠하이머 치매의 새로운 치료 타겟의 가능성을 제시한다.
□ 실용화된다면 어떻게 활용될 수 있나?
별세포의 자가포식 기전의 규명을 통해 신경세포의 생존과 기능 유지를 촉진 할 수 있는 치료법 개발을 통해서 알츠하이머, 파킨슨병등의 다양한 신경퇴행성 질환의 치료에 혁신적인 기여를 기대한다. 더 나아가 자기포식 기전을 조절하는 약물의 개발로 환자 개개인에 최적화된 치료법에 제공 가능성을 볼 수 있다. 이는 자가포식과 관련된 세포 생물학적 기전 이해를 증진 시키고, 세포 내 노폐물 제거 및 세포건강 유지에 관한 기초 연구의 발전을 가져올 수 있다.
□ 기대효과와 실용화를 위한 과제는?
별세포의 자가포식 기전 연구는 신경질환 치료의 새로운 패러다임을 제시할 수 있으며, 생명과학 분야의 다양한 혁신을 이끌어낼 잠재력을 가지고 있다. 실용화를 위해서는 임상 연구, 기술 상용화, 규제 승인 등의 과제를 해결해 나가야 하며, 지속적인 연구 지원과 협력이 필요하다. 즉, 동물모델에서의 실험 결과를 바탕으로 인간 대상의 임상 연구 계획 및 실행을 진행하고, 자가 포식 기전 조절을 위한 약물 개발 및 생산 공정을 통해서 기술 상용화를 현실화할 수 있을 것으로 보인다.

[그림 1] 별세포(성상 교세포)의 자가포식 관련 유전자의 조절은 알츠하이머 치매환자의 뇌안에서 아밀로이드 베타 (Aβ)를 효과적으로 제거하는데 작용하는 중요한 기전임을 증명함.
별세포의 자가 포식 기전은 알츠하이머병에서 중요한 조절 요소로 작용함을 보여준다. 알츠하이머병에서 별세포의 자가포식 조절 유전자(LC3B, SQSTM1)가 활성화 되면 아밀로이드 베타 (Aβ)의 제거가 이루어져 인지 기능 회복에 중요한 역할을 함을 보여줌. [사진=KIST]

[그림 2] 치매 환자 뇌조직에서 별세포 특이적으로 자가포식 유전자의 발현의 증가 양상을 확인함. [사진=KIST]
(A) 치매 환자의 뇌조직에서 별세포 (GFAP) 특이적인 자가포식 인자 (LC3B) 발현 (파랑색 점으로 관찰)의 증가 양상을 확인함.
(B) 치매환자의 뇌 조직에서 활성화된 별세포가 증가하고 또한 자가포식 유전자의 발현이 증가하는 것을 확인함.
(C) 치매환자의 뇌 조직에서 별세포의 증가에 따라 자가포식 유전자의 증가가 일어나는 상관관계가 있음을 확인함.
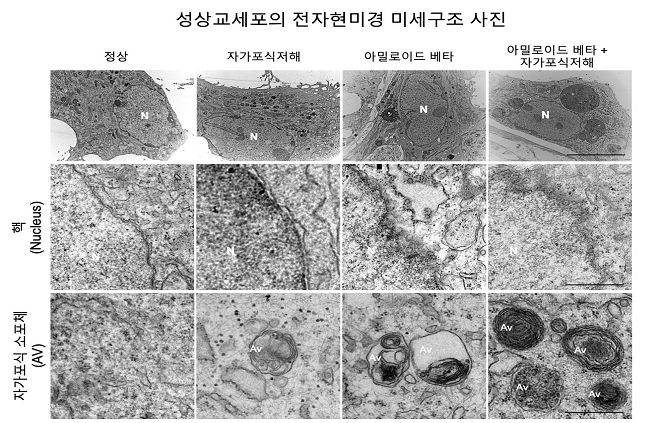
[그림 3] 별세포내에서 자가포식 작용이 억제될 경우에 의 자가포식 소포가 쌓여져 아밀로이드 베타 (Aβ)의 제거가 억제됨. [사진=KIST]
별세포의 특이적인 자가포식 작용의 억제는 아밀로이드 베타 (Aβ)를 제거하기 위한 자가포식 소포(autophagy vesicle)를 통한 아밀로이드 베타 (Aβ)의 제거가 이루어지지 않아서 치매 병리를 나쁘게 변화 시킬 수 있음 보여주는 증거임.
본 기사는 네티즌에 의해 작성되었거나 기관에서 작성된 보도자료로, BRIC의 입장이 아님을 밝힙니다. 또한 내용 중 개인에게 중요하다고 생각되는 부분은 사실확인을 꼭 하시기 바랍니다.
BRIC(ibric.org) Bio통신원(KIST) 등록 2024.08.26