[바이오토픽] 코로나바이러스 α의 전파력과 감염력을 증가시킨 변이 확인
B.1.1.7 변이주—α라고도 불린다—가 기존의 코로나바이러스보다 신속히 확산되는 것은, 인체의 초기 면역반응을 약화시키는 능력을 부여한 변이 때문인 것으로 보인다.

신속히 확산되는 코로나바이러스 변이주가, 기존에 유행하던 변이주들보다 더 빨리 전파되는 이유가 새로 밝혀졌다. 그것은 인체의 1차 방어선을 둔화(약화)시키기 때문이라고 한다.
지난해에 영국에서 처음 탐지된 이후, B.1.1.7 변이주—α라고도 불린다—는 전 세계를 헤집고 다니며 지배적인 형태의 SARS-CoV-2로 자리 잡았다. 일부 연구에서는, 기존에 유행한 변이주를 앞지르는 α의 능력이 (숙주 세포에 보다 효율적으로 침입하도록 허용하는) 스파이크 단백질의 변이에 기인한다고 보고했다.
그러나 UCSF와 UCL의 연구팀이 6월 7일 《bioRxiv》에 포스팅한 출판전 논문에 따르면(참고 1), α는 또 한 가지 변이를 이용하여 농간을 부린다고 한다. 그것은 스파이크 단백질 외부의 변이로, 사람을 감염시킨 지 몇 시간 안에 선천성 면역반응(인체가 모든 침입자들에 대항하여 가동하는 1차 방어선)을 억제하게 해 준다고 한다. 그리고 그 변이 덕분에 선천성 면역반응(innate immune response)을 차단한 바이러스는, 다른 사람들을 감염시킬 기회를 더 많이 얻게 된다고 한다.
"그 변이는 α로 하여금 선천성 면역을 주무르거나 회피하게 하는데, 우리가 생각하기에 선천성 면역은 바이러스의 전파에 매우 중요하다"라고 이번 논문의 공저자인 유니버시티 칼리지 런던(UCL)의 클레어 졸리(바이러스학)는 말했다.
졸리와 동료들은 in vitro에서, 인간의 기도에서 채취한 세포들이 인터페론(interferon)—병원체가 침입하자마자 인체의 방어선에 시동을 거는 면역단백질—을 어떻게 생성하는지를 조사했다. 그 결과, α에 감염된 세포들은 기존의 SARS-CoV-2 변이주에 감염된 세포들보다 인터페론을 훨씬 덜 생성하는 것으로 나타났다. 인터페론의 생성이 억제된다면, 변이주가 체내에 더 오랫동안 머무르는 데 도움이 된다.
간섭하는 단백질 (참고 2)
또한, α에 감염된 세포는 'Orf9b라는 단백질을 코딩하는 바이러스의 RNA'와 'Orf9b 자체'의 수준이 훨씬 더 높은 것으로 나타났다. 연구진은, Orf9b가 (전형적으로 인터페론의 생성을 활성화하는) 숙주의 단백질과 (선천성 면역반응에 중요한) 다른 유전자들을 간섭함으로써 인체의 방어망을 약화시킨다는 사실을 발견했다.
UCSF와 UCL 연구팀의 논문은 아직 동료심사를 받지 않았다.
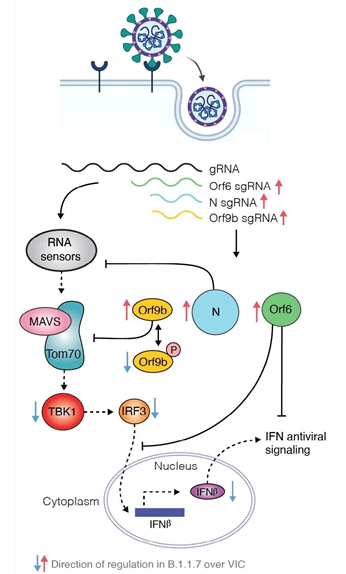
B.1.1.7이 선천성 면역의 활성화를 억제하는 메커니즘
전파력이 높은 SARS-CoV-2인 B.1.1.7은 선천성 면역반응을 효과적으로 억제하도록 진화했다. Orf9b, Orf6, N은 선천성 면역 길항제로, 다양한 수준에서 RNA의 감지를 억제하는 것으로 알려져 있다. Orf6는 인터페론 조절 전사인자(IRF3)와 STAT1의 핵내 이동(nuclear translocation)을 억제하고, N은 RNA 센서인 RIG-I16의 활성화를 억제한다. 이번 연구에서, Orf9b는 (인산화에 의해 조절되는) TOM70과의 상호작용을 통해 RNA의 감지를 억제하는 것으로 밝혀졌다. 그리고 B.1.1.7은 핵심적인 선천성 면역 길항제들을 위해 더 많은 sgRNA(subgenomic RNA)를 생성하도록 진화함으로써, 기존의 바이러스보다 많은 단백질들을 만들어 면역 억제능력이 향상된 것으로 밝혀졌다.
지난 3월 4일 서호주 대학교의 실바나 가우디에라(면역유전학)가 이끄는 연구팀이 《bioRxiv》에 포스팅한 논문(참고 3)은 이번 발견의 일부를 뒷받침한다. 연구팀은 α에 감염된 사람에게서 채취한 바이러스 샘플을 분석하여, 선행 변이주에 감염된 사람에 비해 RNA의 발현—이는 아마도 Orf9b의 생성을 나타내는 것 같았다—이 유의미하게 높다는 사실을 발견했다.
서호주 대학교 연구팀은 이러한 과잉발현을 스파이크 단백질 외부의 단백질(뉴클레오캡시드)을 코딩하는 유전자의 변이(28280:GAT>CAT, D3L)에 귀속시켰다. "UCSF와 UCL 연구팀의 논문은, 스파이크 단백질을 넘어서 새로운 변이를 찾는 것이 중요하다는 것을 시사한다"라고 가우디에라는 말했다. 서호주대학교 연구팀의 논문도 아직 동료심사를 받지 않았다.
졸리와 함께 연구를 수행한 UCSF의 내밴 크로간(유전학)에 의하면, 그들은 현재 다른 우려변이(VOC: variant of concern)로 분석을 확장하고 있다고 한다. "α는 엄청나게 교활하다"라고 크로간은 말했다. "문제는, 그놈이 또 다른 농간을 부릴지도 모른다는 것이다."
※ 참고문헌
1. https://doi.org/10.1101/2021.06.06.446826
2. https://www.nature.com/articles/d41586-021-01540-8
3. https://doi.org/10.1101/2021.03.02.433156
※ 출처: Quantitative Biosciences Institute https://currently.att.yahoo.com/att/ucsf-qbi-university-college-london-123500909.html
바이오토픽 양병찬 (약사, 번역가)

서울대학교 경영학과와 동대학원을 졸업하고, 은행, 증권사, 대기업 기획조정실 등에서 일하다가, 진로를 바꿔 중앙대학교 약학대학을 졸업하고 약사면허를 취득한 이색경력의 소유자다. 현재 서울 구로구에서 거주하며 낮에는 약사로, 밤에는 전문 번역가와 과학 리...
의학약학 양병찬 (2021-06-10)
https://www.ibric.org/myboard/read.php?Board=news&id=331679