[바이오토픽] 새로운 DNA 알파벳, Z의 생합성 경로 밝혀져
'에일리언'은 우주에만 있는 게 아니다. 지구상에서도 에일리언 같은 유전체가 발견될 수 있다. 세균을 감염시키는 바이러스들 중 몇몇은 (거의 모든 생물들이 사용하는 코드와 구별되는) 대안적인 유전자 알파벳을 이용하기 때문이다. 이제 두 연구팀은 그 시스템이 작동하는 원리를 판독했다.
40여 년간의 연구 끝에, 연구팀들은 박테리오파지(또는 단순히 '파지')라고 알려진 수십 가지 바이러스들이 아데닌(adenine)─유전학 교과서에 나오는 A, T, C, G 중에서 A─대신 「2-아미노아데닌(2-aminoadenine)」─코드명 Z─이라는 화학적 염기를 이용하여 자신들의 유전체를 쓰는 과정을 상세히 설명했다.
"과학자들은 오랫동안 염기의 다양성을 증가시키는 꿈을 꿔 왔다. 우리의 연구는 자연이 이미 그런 방법 중 하나를 마련했다는 사실을 증명했다"라고 상하이과기대학(上海科技大学)의 계산생물학자 자오쑤원(赵素文)은 말했다. 그녀가 이끄는 연구팀은 4월 29일 《Science》에 실린 논문(참고 1)에서 'Z-DNA'가 만들어지는 과정을 기술했다. 그리고 프랑스 파스퇴르 연구소의 연구팀은 같은 저널에 실린 두 편의 논문(참고 2, 참고 3)에서 비슷한 통찰을 기술했다.
"이번 연구는 합성생물학의 새 장(章)을 열었다"라고 플로리다주 앨라추아 소재 응용분자유전학재단(Foundation for Applied Molecular Evolution)의 설립자인 스티븐 베너(합성생물학)는 말했다. 그는 이번 연구를 미국의 미생물학자 칼 우즈(Carl Woese; 참고 4)가 단세포생물의 새로운 가지(branch)를 발견한 것에 비유했다. "지금으로부터 50년 전 우즈가 고균(Archaea)을 발견한 이후, 그림자 생물권(shadow biosphere)이 발견된 것은 이번이 처음이다."

결합 강화제(bond booster)
구(舊)소련의 과학자들은 1970년대 초 광합성 세균을 감염시키는 S-2L이라는 파지에서 최초의 Z-DNA를 발견했다(참고 5). 그들의 발견에 따르면, S-2L의 DNA는 두 개의 나선형 가지가 녹아서 분리될 때 이상한 행동을 보였다. 즉, G와 C 염기 사이에서 형성된 결합(수소결합 3개)은 A와 T를 연결하는 결합(수소결합 2개)보다 높은 온도에서 끊어지는 게 상례인데, S-2L의 DNA는 마치 '주로 G와 C로 구성된 것처럼' 행동한 것이다. 그러나 연구팀이 추가로 분석한 결과, S-2L는 A를 Z로 대체함으로써 T와 더욱 강력한 결합을 형성한 것으로 밝혀졌다.

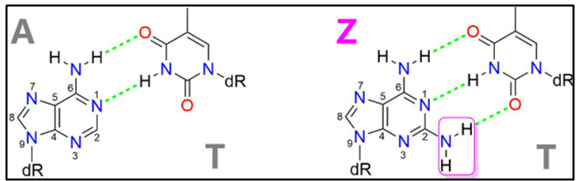
☞ 견고한 유전체
특정 바이러스에서 유전자 알파벳 중 'A'를 대체하는 'Z' 염기는 2개 대신 3개의 수소결합(hydrogen bond)을 형성함으로써, 두 가닥의 DNA를 떼어내기가 훨씬 더 어렵게 만든다.

"그건 뭐랄까, 관습에 도전하는 것처럼 보였다"라고 이번에 《Science》에 실린 연구 중 하나를 지휘한 프랑스 에브리 대학교의 필립 말리에스(유전학)는 말했다. "그 파지가 그처럼 특별한 염기를 가진 이유가 뭐였을까?"
후속연구에서, S-2L의 강력한 유전체는 'DNA를 써는 효소'와 세균이 구사하는 그 밖의 '항파지 방어선'에 저항하는 것으로 나타났다. 그러나 Z-DNA 시스템이 '어떻게 작동하는지'와 '얼마나 흔한지'는 미스터리로 남았다. Z-DNA는 파지의 DNA에 존재하는 것으로 알려진 '여러 가지 변형' 중 하나일 뿐이라고 치부된 것이다.
이러한 미스터리를 해결하기 위해, 프랑스 파리에 있는 파스퇴르 연구소의 말리에르와 피에르-알렉상드로 카민스키(생화학)는 2000년대 초 S-2L의 유전체를 시퀀싱했다. 그 결과, 그들은 Z-DNA를 만드는 단계 중 하나에 부분적으로 관여하는 유전자 중에서 겨우 하나만을 발견했다. 게다가 그 당시의 유전체 데이터베이스에는 그 시퀀스와 비교할 만한 게 없었으므로, Z-DNA의 기초를 이해하려던 연구팀은 막다른 골목에 몰렸다.
짜릿한 순간
말리에르와 동료들은 S-2L의 유전체에 대한 특허를 출원했지만, 그 내용을 공개하고 유전체 데이터베이스를 샅샅이 뒤지는 작업을 계속했다. 그러던 중 2015년, 연구팀은 마침내 안타를 쳤다. 비브리오속(Vibrio)에 속하는 수생세균(aquatic vacteria)을 감염시키는 파지가, S-2L 유전체의 신장부(stretch)와 일치하는 유전자를 보유한 것으로 밝혀진 것이다. 그 유전자는 하나의 효소를 코딩하는데, 생김새가 '세균이 아데닌을 만드는 데 사용하는 효소'와 비숫했다. "그건 짜릿한 순간이었다"라고 말리에르는 말했다.
그리고 2019년 赵가 이끄는 연구팀은 유전체 데이터베이스에서 비슷한 유전자를 발견했다. 두 팀이 밝혀낸 것은, 그 파지들이 모두 PurZ라는 유전자를 보유한다는 것이었다. PurZ는 어떤 효소를 코딩하는데, 그 효소는 (세균의 세포 안에 존재하는) 전구체 분자로부터 Z 뉴클레오타이드를 만드는 초기 단계에서 결정적인 역할을 수행한다. 다음으로, 두 연구팀은 추가적인 효소들—파지가 감염시키는 세균의 유전체에 코딩됨—을 확인함으로써 Z-DNA의 합성경로를 완성했다.

두 연구팀이 이번에 《Science》에 발표한 논문에도 불구하고, 한 가지 핵심적인 문제는 여전히 남았다. 연구팀들이 확인한 효소들이 Z-DNA의 원료—dZTP라고 불리는 분자—를 생산하는 것은 맞지만, 파지들이 그 분자를 DNA 가닥에 삽입함과 동시에 A 염기(dATP라는 화합물의 형태임)를 배제하는 메커니즘은 밝혀지지 않은 것이다.
이 부분에서 두 팀의 결론은 약간 달랐다. 비브리오 파지의 유전체 속에서, PurZ 옆에는 (DNA 가닥을 복사하는) 폴리머레이스(polymerase)라는 효소를 만드는 유전자가 버티고 있다. 말리에르와 카민스키는 '파지의 폴리머레이스가 dZTP를 DNA에 통합하는 한편, 도입된 A 염기를 모두 잘라낸다'는 사실을 발견했다. "그것은 A가 배제되는 이유를 설명해 준다. 그것은 정말로 장관이었다"라고 카민스키는 말했다.
그러나 赵는, 그게 풀스토리가 아니라고 생각한다. 그녀의 연구가 시사하는 것은 '또 하나의 파지 효소가 필요한데, 그 역할은 dATP를 잘라내지만 dZTP를 세포 안에 보존하는 것'이라는 것이다. 그녀가 발견한 바에 따르면, 'dZTP/dATP 비율'을 증가시키는 것만으로도 세포의 폴리머레이스를 속여 Z-DNA를 만들게 할 수 있다.
누락된 연결고리(참고 6)
"우리가 모르는 게 아직 많다"라고 赵는 말했다. 숙주가 자신의 DNA에 Z를 들이지 않는 방법은 불분명하다. 또한 Z-DNA는 통상적인 DNA 분자와 약간 다른 형태의 이중나선을 형성하는데, (단백질을 만들기 위해 DNA를 읽는) 세포기구가 Z-DNA에 대처하는 방법도 명확하지 않다. 마지막으로, Z-DNA가 복제되는 과정(여기에는 폴리머레이스 말고, 전문화된 효소가 필요할 것으로 보인다)도 완전히 이해되지 않았다. "심지어 우리는 전체적인 시스템이 작동하는 메커니즘을 아직 모른다"라고 카민스키는 덧붙였다.
"Z-DNA를 만드는 동안, 숙주 효소의 기능은 향상되거나 손상될 수 있다"라고 조지아주 애틀랜타 소재 에모리 대학교이 데이비드 던랩(생물물리학)은 말했다. 그는 E. coli의 효소가 이국적인 이중나선을 꼬고 구부리느라 애를 먹는다는 사실을 발견한 적이 있다(참고 7). Z-DNA를 보유한 파지들이 더 많이 발견되었고, 그 분자를 만드는 데 관여하는 유전자들도 발견되었으므로, 연구자들이 파지들이 Z-DNA를 사용하는 것의 이점을 이해하는 데 탄력이 붙을 것으로 보인다.
"관련된 유전자들을 손에 넣었으니 만큼, Z-DNA이 더욱 쉽고 저렴하게 생산됨으로써 잠재적인 응용이 가속화될 것이다"라고 赵는 말했다. Z-DNA의 견고함은, DNA 데이터 보관(data storage)의 초창기 기법을 더욱 안정적이고 내구적으로 만들 것이다. 정밀하게 배열된 Z-DNA로 구성된 나노머신—일명 DNA 오리가미—은 더욱 신속히 접혀 3D 형태를 만들 것이다. 프랑스의 연구팀은 Z-DNA를 세균의 유전체에 통합하는 방안을 모색하고 있다. "우리는 '제드(Zed)'에게 침범당한 E. coli 세포를 갖고 있다. 그것은 우려할 만한 수준의 독성을 발휘하지 않는다"라고 말리에르는 말했다.
베너—그가 이끄는 연구팀은 여러 개의 인공 DNA 염기를 포함할 수 있도록(참고 8; 한글번역), 유전자 알파벳을 확장한 바 있다(참고 9)—는 연구자들이 이번 연구에 자극을 받아, '유전자 알파벳을 바꾸기'의 힘을 깨닫게 되기를 바란다. "자연이 우리가 가는 방향으로 작은 걸음을 내디뎠다는 것은, 분자생물학계가 'DNA는 개선될 수 있으며, 그게 우리에게 이로울 수 있다'는 점을 이해하는 데 필요한 지적 카페인(intellectual caffeine)이다"라고 그는 말했다.
※ 참고문헌
1. https://doi.org/10.1126%2Fscience.abe4882
2. https://doi.org/10.1126%2Fscience.abe6494
3. https://doi.org/10.1126%2Fscience.abe6542
4. https://www.ibric.org/myboard/read.php?Board=news&id=289989&SOURCE=6
5. https://doi.org/10.1038%2F270369a0
6. https://www.nature.com/articles/d41586-021-01157-x
7. https://doi.org/10.1016%2Fj.jmb.2015.04.006
8. https://www.nature.com/articles/d41586-019-00650-8 (한글번역 https://www.ibric.org/myboard/read.php?Board=news&id=302608&SOURCE=6)
9. https://doi.org/10.1126%2Fscience.aat0971
※ 출처
1. 上海科技大学 https://www.shanghaitech.edu.cn/eng/2021/0502/c1260a63401/page.htm
2. Instut Pasteur https://www.pasteur.fr/en/home/press-area/press-documents/genetics-biosynthesis-pathway-new-dna-nucleobase-elucidated
바이오토픽 양병찬 (약사, 번역가)

서울대학교 경영학과와 동대학원을 졸업하고, 은행, 증권사, 대기업 기획조정실 등에서 일하다가, 진로를 바꿔 중앙대학교 약학대학을 졸업하고 약사면허를 취득한 이색경력의 소유자다. 현재 서울 구로구에서 거주하며 낮에는 약사로, 밤에는 전문 번역가와 과학 리...
생명과학 양병찬 (2021-05-20)
https://www.ibric.org/myboard/read.php?Board=news&id=331011