면역세포의 지휘자인 헬퍼 T세포를 활용한 차세대 면역 항암 기술 개발
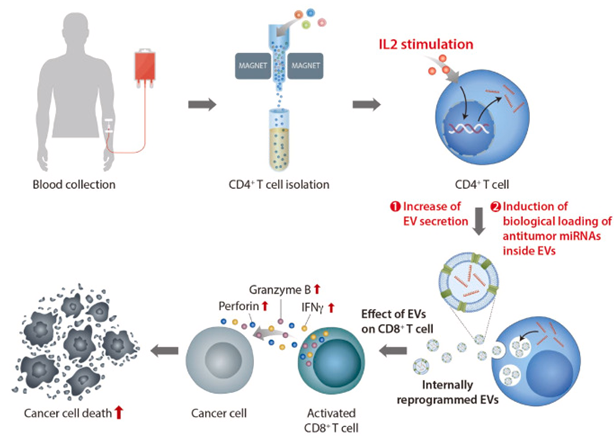
DGIST(총장 국양) 뉴바이올로지학과 예경무 교수팀과 경북대학교 의과대학 백문창 교수팀이 ‘신개념 면역 항암 치료 기술’을 개발했다. 기존의 화학항암제는 암세포를 단순히 사멸하는 정도에 그치지만, 연구팀이 개발한 기술은 헬퍼 T 세포(CD4+ T cells)에서 분비된 세포외소포체를 이용한 기술로 환자의 면역 시스템을 활성화하여 흑색종과 같은 고형암을 효과적으로 치료하면서, 암세포 억제까지 가능한 ‘차세대 면역 항암 기술’이라 볼 수 있다.
현재까지 세포외소포체를 이용한 치료 방법은 주로 중배엽 줄기세포의 세포외소포체를 활용한 면역억제 치료 또는 일반 세포외소포체에 화학항암제를 넣어 특정 부위에 전달하는 이른바 ‘drug delivery’를 위한 목적으로 개발됐다. 하지만, 최근 새로운 연구들을 통해 T세포에서 유래된 세포외소포체가 항암 효능(종양 발달 억제)이 있다는 증거가 발견되고 있다.
T세포는 세포성 면역을 담당하는 림프구의 일종으로 수행하는 역할에 따라 구분되어 지는데, 헬퍼 T세포는 다른 면역 세포들을 활성화시키고 지휘하는 역할을 담당하며, 세포독성 T세포는 바이러스에 감염된 세포, 종양 세포, 기능이 손상된 세포 등을 제거하는 역할을 한다.
예경무 교수팀은 항암 기능의 잠재력이 매우 높지만 아직까지 체계적인 연구가 없었던 헬퍼 T세포 유래 세포외소포체를 주목했고, 이것이 세포독성 T세포의 활성과 증식을 유도하여 결국 흑색종을 효과적으로 억제하는 것을 확인하였다. 흥미로운 사실은 헬퍼 T세포에 인터류킨-2와 같은 면역 활성 유도 사이토카인을 처리하면 세포외소포체가 보다 더 강력한 항암 효능을 나타냈다.
연구 결과 헬퍼 T세포 유래 세포외소포체는 비단 흑생종 치료에 국한되지 않고 다양한 난치성 암 치료 외에 세포외소포체를 활용한 단독 치료 뿐만 아니라 기존의 화학 항암제나 면역 항암 항체 치료제 등과 함께 활용될 수 있어 면역항암제로서의 응용 잠재력이 높을 것으로 기대하고 있다.
DGIST 뉴바이올로지학과 예경무 교수는 “신개념의 항암 치료 기술 개발을 위해 공동연구를 수행한 경북대학교 의과대학 백문창 교수님, DGIST 신상희 학생, 정인성 학생에게 감사드린다”며, “해당 기술이 난치성 암 치료의 새로운 돌파구로 활용되어 암 환자들에게 도움이 되길 희망한다”고 밝혔다.
한편, 이번 연구는 한국연구재단의 바이오의료기술개발사업단의 지원을 통해 수행되었으며, 연구 결과는 Biomaterials에 게재됐다.
연 구 결 과 개 요
Novel antitumor therapeutic strategy using CD4+ T cell-derived extracellular vesicles(sciencedirect.com)
Sanghee Shin, Inseong Jung, Dokyung Jung, Christine Seulki Kim, Sung-Min Kang, Suyeon Ryu, Sung-Jin Choi, Soojeong Noh, Jongwon Jeong, Beom Yong Lee, Jun-Kook Park, Jiwon Shin, Hanchae Cho, Jong-Ik Heo, Youngtae Jeong, Shin Yup Lee, Sun Ha Choi, Moon-Chang Baek*& Kyungmoo Yea*
(Biomaterials, published on 31st Aug, 2022)
세포외소포체(EV)는 세포에서 유래한 생리활성 분자를 운반함으로써 세포간의 커뮤니케이션을 매개한다. 최근 면역세포 유래 EV는 종양 진행과 같은 주요 생물학적 기능을 조절하는 것으로 보고되었다. 헬퍼 T 세포(CD4+ T 세포)는 전반적인 면역을 조정하는 것으로 알려져 있지만 헬퍼 T 세포 유래 EV의 생물학적 역할은 불분명한 상황이다. 우리는 본 연구에서 CD4+ T 세포에서 파생된 EV는 조절 T 세포(Treg)에 영향을 주지 않으면서 증식 및 활성을 향상시켜 CD8+ T 세포의 항종양 반응을 증가시킨다는 사실을 밝혔다. 더욱이, 인터류킨-2(IL2)가 자극된 CD4+ T 세포에서 유래된 EV는 IL2가 자극되지 않은 EV에 비해 CD8+ T 세포의 더 향상된 항종양 반응을 유도한다. 기전적으로, EV 내의 miR-25-3p, miR-215-5p 및 miR-375는 CD8+ T 세포에 의한 항종양 반응의 유도를 담당하는 것으로 밝혀졌다. 흑색종 마우스 모델에서 EV는 CD8+ T 세포 활성화를 통해 종양 성장을 강력하게 억제했다. 이 연구는 EV와 IL2가 CD4+와 CD8+ T 세포 사이의 중요한 커뮤니케션 매개체임을 처음으로 보여준다. 또한 임상적으로 항종양 요법으로 사용되는 IL2와 달리 CD4+ T 세포 유래 EV는 Treg를 활성화하지 않고 CD8+ T 세포를 자극했다. 따라서 CD4+ T 세포 유래 EV는 CD8+ T 세포 매개 항종양 반응을 유도함으로써 암 면역 요법의 새로운 방향을 제시할 수 있다.
연 구 결 과 문 답
이번 성과 무엇이 다른가
기존의 세포외소포체 기반 치료제 기술은 주로 줄기세포 유래 세포외소포체 중심임. 따라서 타겟 질환도 면역질환에 초점이 맞춰줘 있음. 하지만
본 연구에서는 헬퍼 T세포 유래 세포외소포체의 면역항암치료기술을 제시하므로써 고형암과 같은 새로운 질병을 타깃팅하는 세포외소포체를 제안한다는 큰 의미가 있음
어디에 쓸 수 있나
본 연구에서는 피부암, 특히 흑색종의 치료 효능을 증명하였지만 향후 여러 암종에 걸친 추가 연구가 진행된다면 간암, 폐암등 환자군이 많은 난치암 치료에도 응용될 가능성이 매우 높음
실용화까지 필요한 시간과 과제는
1~2년 정도 전임상 연구를 통해 독성, 약동학, 약리학적 연구가 진행되야 하고 세포외소포체 생산관련 연구가 2~3년 마지막으로 임상연구가 4~5년 추가적으로 진행되어야 실제 치료제로 사용 가능함. 효능 문제 보다는 세포외소포체를 대량생산하는 기술과 인프라 확보가 최대 관건이 될듯함
연구를 시작한 계기는
T 세포 유래 세포외소포체의 기능연구가 최근에 하나둘씩 보고가 되었고 면역세포가 세포이소포체를 분비하여 주변 세포들 특히 암세포를 조절한다는 사실이 밝혀지면서 본 연구를 기획하게 됨
어떤 의미가 있는가
헬퍼 T세포의 세포외소포체가 세포독성 T세포의 활성과 증식을 도모하여 결과적으로 체내의 암세포를 제거한다는 발견은 기초과학은 물론이고 향후 임상적 적용을 기반한 응용연구에 큰 돌파구를 제안하는 것임. 현재 각광받고 있는 여러 면역항암제나 화학항암제와 병용치료 수단으로 응용된다면 임상적 잠재력은 무궁무진함
꼭 이루고 싶은 목표는
본 원천기술을 잘 상용화하여 많은 암환자에게 실질적으로 도움을 주는 것을 직접 보고 뿌듯함을 느끼고 싶음. 또한 미래엔 임상적 적용 가능성을 확인하여 자랑스런 대한민국의 항암 치료 기술 중 하나가 될 수 있기를 희망함.

의학약학 DGIST (2022-11-24)