맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. KAIST 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
KAIST(총장 이광형)는 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
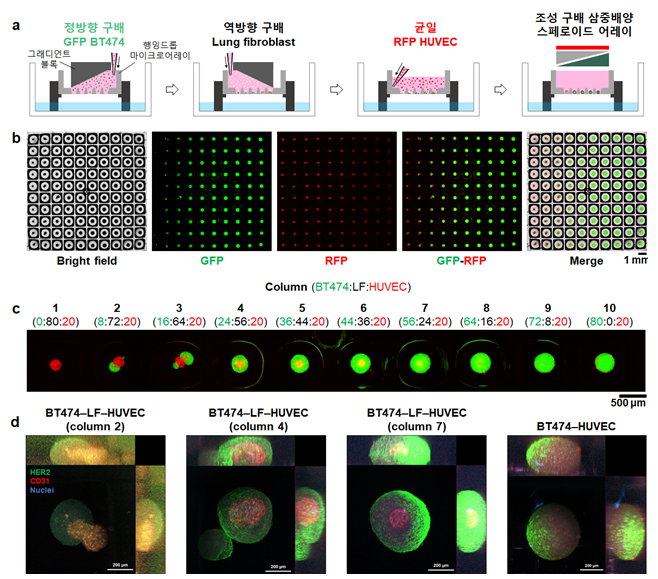
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
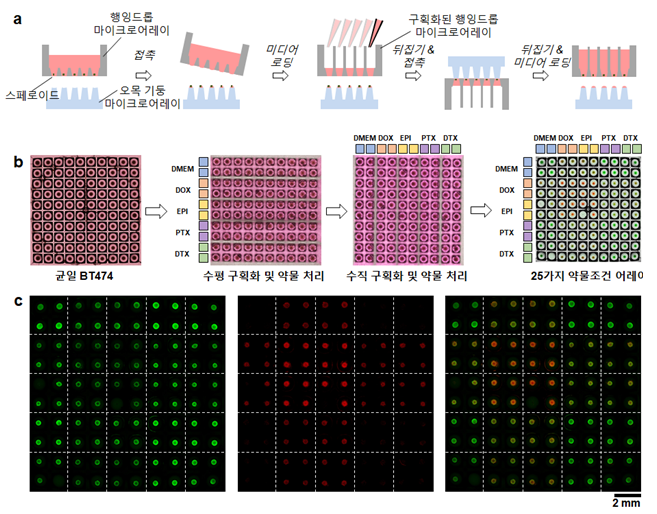
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
KAIST 바이오및뇌공학과 김휘수 박사가 제1저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재되었다(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array). 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의“핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)”세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
□ 연구개요
1. 연구 배경
- 스페로이드(spheroid)는 제작이 간단하며 체내 미세환경의 구조적 및 기능적 특성을 재현할 수 있어 효과적인 3D 세포배양 모델로 여겨졌음.
- 대표적인 스페로이드 제작 방법인 행잉드롭(hanging drop)과 저점착(low-attachment) 웰 플레이트는 스페로이드가 서로 분리된 환경에 존재하기에 약물 스크리닝에 적용할 수 있었으나 사용하는 스페로이드의 개수에 비례하여 노동력 및 시간이 증가하는 단점이 존재함.
- 또한, 종래의 마이크로웰 어레이 플랫폼은 균일한 스페로이드를 대규모로 생성하는 것에 성공하였으나, 만들어진 스페로이드들은 항상 동일한 환경조건에 노출되기 때문에 고효율 스크리닝에 적용할 수 없었음.
한편, 스페로이드의 크기와 세포 조성은 스페로이드의 기능, 세포 전이, 약물 저항성 등 다양한 측면에 큰 영향을 미칠 수 있음. 이러한 관점에서 다양한 세포 종류로 구성된 공배양 및 삼중 배양 스페로이드는 종양 미세환경을 더 잘 모방하고 질병 기전 및 약물 스크리닝 연구에 더 정확한 모델을 제공할 수 있을 것으로 기대되나 현재의 스페로이드 제작 방법으로는 구현이 어려웠음.
본 연구진은 다양한 크기나 세포 조성을 갖는 스페로이드 어레이를 고효율로 제작할 수 있으면서도, 생성된 스페로이드들을 고효율 약물 스크리닝에 적합하게 조작할 수 있는 새로운 조립형 체외 세포배양 플랫폼인 “클릭-스페로이드(CLiCK-Spheroid)”를 개발하였음.
2. 연구 내용
- 행잉드롭 마이크로어레이(hanging drop microarray)는 균일한 조건의 스페로이드 어레이를 피펫팅 한 번으로 제작하고, 배양 접시와 접촉시켜 스페로이드를 일괄적으로 회수하는 것이 가능했음. 이때, 세포 혼합용액을 피펫팅으로 주입하기 전에 행잉드롭 마이크로어레이와 그래디언트 블록(gradient block)이 조립된 상태면, 그래디언트 블록의 경사면을 따라 세포 혼합용액의 높이가 변화하게 됨. 이에 따라, 경사면 방향으로 다른 수의 세포가 각 구멍에 가라앉게 되어 크기가 다른 스페로이드들로 구성된 어레이가 만들어짐.
- 여러 종류의 세포 현탁액을 행잉드롭 마이크로어레이에 주입할 때 그래디언트 블록의 사용 유무 및 조립 방향(좌, 우)에 따라 다양한 세포 조성을 가지는 공배양 및 삼중배양 스페로이드 어레이를 손쉽게 만들 수 있어, 세포 조성에 따른 스페로이드의 형태 및 주변 혈관망과의 상호작용 차이를 분석할 수 있었음.
- 제작된 스페로이드 어레이들은 행잉드롭 마이크로어레이의 하부에 오목 기둥 마이크로어레이(concave pillar microarray)를 접촉하여 작은물방울 형태로 각각 분리할 수 있었음.
- 같은 행잉드롭 마이크로어레이에서 생성된 스페로이드 어레이를 서로 다른 환경으로 구획화하여 다른 종류 또는 다양한 농도의 약물을 처리할 수 있었고, 이를 응용해 5종 약물을 순차적으로 2번 처리할 때 가질 수 있는 25가지 조합을 한 스페로이드 어레이 내에서 구현하여, 고효율 약물 스크리닝의 적용 가능성을 입증했음.
3. 기대 효과
- 클릭-스페로이드는 다양한 스페로이드 어레이를 원하는 대로 대규모로 제작할 수 있을 뿐 아니라, 연구자의 필요에 따라 스페로이드 어레이를 구획화하고 결합할 수 있는 유연성을 강점으로 갖추고 있음.
- 이는 스페로이드 제작 및 분석 실험에서 오는 노동 집약성을 해결하고 연구 효율성을 크게 높일 것으로 기대됨. 특히 기존의 노동 집약적인 실험 과정으로 인해 수행이 어려웠던 스페로이드의 크기와 세포 조성에 따른 스페로이드 기능 변화를 보는 스크리닝 실험을 대규모로, 간편하게 진행할 수 있다는 점에서 중요한 의의를 가짐.
- 클릭-스페로이드는 공배양, 삼중배양 등 복잡한 스페로이드 외에도 오가노이드 어레이의 맞춤형 제작 및 분석에 응용하여, 높은 생체모사도(인체와 비교하여 생물학적 기능 또는 반응이 유사하게 나타나는 정도)를 기반으로 약물 반응 및 질병 메커니즘을 조사할 수 있는 고효율, 고정밀 체외 스크리닝에 응용될 수 있을 것으로 기대됨.


본 기사는 네티즌에 의해 작성되었거나 기관에서 작성된 보도자료로, BRIC의 입장이 아님을 밝힙니다. 또한 내용 중 개인에게 중요하다고 생각되는 부분은 사실확인을 꼭 하시기 바랍니다.
BRIC(ibric.org) Bio통신원(KAIST) 등록일2024.06.27