단일 분자로도 측정 가능한 고효율 신약발굴 센서 개발
국내 연구진이 신약개발에 드는 시간과 비용을 획기적으로 줄일 수 있는 신약발굴 센서를 개발하였다.

한국생명공학연구원(원장 김장성, 이하 생명연) 바이오의약연구부 지승욱 박사 연구팀은 단일 분자 수준에서 극미량, 초고감도로 측정 가능한 고효율 신약발굴용 나노포어(nanopore) 센서를 세계 최초로 개발하였다고 밝혔다.
이를 통해 신약개발의 효율성을 높이고, 그동안 후보물질 탐색이 어려웠던 질환 표적들에 대한 새로운 신약개발 접근법을 제시할 수 있을 것으로 기대되고 있다.
신약개발의 첫 단추인 후보물질 발굴은 표적 질환 단백질과 약물 간 결합을 분석하는 것이 관건이나 기존 분석기술의 낮은 효율성으로 인해 후보물질 발굴에 요구되는 많은 비용과 시간으로 어려움을 겪고 있다.
현재까지 개발된 분석기술은 고가의 장비가 필요하거나 여러 분자를 조합(ensemble) 단위로 측정한 신호를 평균 내는 방식으로 민감도가 낮고 많은 양의 시료가 필요하며, 일부 표적 단백질과 약물은 시료의 용해도가 낮아 신약개발에 접근하기가 매우 어려운 실정이다.
나노포어 센서란 수 나노미터(㎚, 10억분의 1m) 크기의 구멍을 통한 이온의 흐름을 전기적으로 측정하는 센서 시스템으로, 생체분자가 나노포어 내부를 통과할 때 발생하는 전기신호를 측정하여 단일 분자의 특성을 분석할 수 있다.
하지만 기존의 나노포어 센서는 크기나 전하가 다양한 단백질을 측정하기 어려우며, 단백질의 약물 결합 여부를 구분하기에는 민감도의 한계가 있었다.
이에 연구팀은 단일 분자(single molecule) 수준에서도 표적 단백질-약물 결합을 분석할 수 있는 고효율 신약발굴용 나노포어 센서를 개발하였다.
연구팀은 단백질 엔지니어링 기술을 이용해 나노미터 크기인 구멍으로 1개의 표적 단백질만 포집할 수 있도록 깔때기 구조로 디자인하였고,
전기삼투(electro-osmosis) 현상을 활용해 다양한 표적 단백질을 한 번에 한 개씩 개별적으로 측정할 수 있어 피코몰(picomole, 1조분의 1 mole) 수준의 극미량의 시료만으로도 초고감도로 약물 스크리닝이 가능하다.
이를 통해 기존 약물 스크리닝 기술인 핵자기공명분광법(NMR)과 비교해 시료량을 약 4500배 절감할 수 있어 매우 경제적이며, 표적 단백질과 약물 시료 준비에 드는 시간과 비용을 현저히 절감해줄 수 있다.
이뿐만 아니라 동일한 표적 단백질에 결합된 서로 다른 저분자 약물들을 민감하게 구분할 수 있는 약물 지문(drug fingerprinting) 기술을 개발하여 효율적인 약효 분석과 약물의 작용 메커니즘을 정확하게 규명할 수 있도록 하였다.
특히 이번에 개발한 센서는 단일 분자에서 단백질-단백질 상호작용과 단백질-단백질 상호작용을 저해하는 약물의 약효 분석도 가능하다.
이를 통해 단백질-단백질 상호작용 표적을 비롯해 그동안 신약개발이 어려웠던 표적들과 낮은 용해도의 난용성 표적들(insoluble targets)에 대해서도 새로운 신약개발 접근의 가능성을 제시하였다.
연구책임자인 지승욱 박사는 “단일 분자로도 표적 단백질-약물 결합을 측정할 수 있는 초고감도의 새로운 나노포어 센서 개발에 성공하여 극미량 시료만으로도 고효율 신약발굴이 가능해질 것이다.”라며,
“향후 신약발굴에 소요되는 시간과 비용을 감소시켜 신약개발의 효율성을 높이고, 단백질-단백질 상호작용과 난용성 표적 등 그동안 신약개발이 어려웠던 표적들에 대해서도 신약개발 가능성이 기대된다.”라고 밝혔다.
한편 이번 연구성과는 4월 4일 세계적인 과학저널인 Nature Communications(IF 17.694) 온라인 판에 게재되었으며,
(논문명 : Single-molecule fingerprinting of protein-drug interaction using a funneled biological nanopore(nature.com) / 교신저자 : 지승욱‧이미경 박사 / 제1저자 : 정기백‧김진식 박사, 류민주 UST KRIBB스쿨 박사과정)
생명연 주요사업, 과기정통부 개인기초연구사업 중견연구, 바이오‧의료기술개발사업, NST 융합연구단 사업의 지원으로 수행되었다.
연 구 결 과 개 요
□ 연구배경
○ 신약개발의 장기간(10년), 고비용(1~3조)의 한계를 극복하고 신약개발 성공 확률을 높이기 위해서는 신약개발 초기에 신약물질의 유효성을 검색하는 신약발굴 단계의 효율성 혁신이 필요하다. 신약후보 물질을 발굴하는 데 있어서 주로 표적 단백질과 약물 간 결합을 분석하는 것이 관건이다.
○ 기존에 핵자기공명법(NMR), 표면 플라스마 공명(SPR), 등온적정 열량계(ITC) 및 형광공명에너지전이(FRET) 등 전통적으로 약물 스크리닝하는 다양한 분석 방법들이 존재하지만, 고가의 장비가 수반되고, 표적 단백질에 표지/고정으로 인한 부정확성, 저분자 약물에 대한 낮은 측정 민감도로 많은 양의 시료가 요구되는 등 기술적 한계에 직면해 있다.
○ 상기한 기존의 분석기술들은 여러 분자들을 조합(ensemble) 단위로 측정한 신호를 평균내는 방식이므로 고농도의 시료가 요구되며, 이에 따라 낮은 용해도의 난용성 표적 단백질의 경우에는 신약개발이 어려운 실정이다.
○ 나노포어 센서(Nanopore)는 나노미터(10-9m) 크기의 구멍을 통한 이온의 흐름을 전기적으로 측정하는 센서 시스템으로서 생체분자가 나노포어를 통과할 때 발생하는 고유의 전기적 신호(피코암페어(pA, 10-12A) 수준의 미세전류)를 측정하여 단일 분자 수준에서 생체분자의 크기, 전하, 구조 및 형태 등을 분석하는 데 사용된다.
○ 나노포어 센서 기술은 나노바이오 융복합 기반의 단분자(single molecule) 측정 기술로서 타 기술보다 초고감도 및 극미량 측정이 가능할 뿐 아니라 무표지된 시료로 단시간 내 저비용으로 측정이 쉬운 기술적 장점을 지닌다. 나노포어 센서 기술은 차세대 유전자 서열분석(next generation sequencing) 기술의 상용화 사례로 주목받고 있으며 그 결과 유전자 서열분석에 소요되는 시간과 비용을 현저하게 절감하였다.
○ 그러나 기존 개발된 나노포어 센서로는 단백질 분석에 적용하는 것은 매우 어려운 상황이다. 제한된 작은 크기의 구멍과 전기영동(electrophoresis)에 기반한 검출 원리로 인해 다양한 크기와 전하를 지닌 단백질들의 측정은 불가하다. 특히 단백질과 결합하여 약효를 나타낼 수 있는 저분자 약물 개발 관련 응용 연구는 거의 전무하다.
□ 연구내용
○ 본 연구진은 단백질 엔지니어링 기술을 활용하여 1개의 표적 단백질만 포집이 가능하도록 나노미터(㎚, 10억분의 1m) 크기의 구멍을 가지는 깔때기 구조의 새로운 나노포어 단백질 센서를 개발하였다. 전자현미경(electron microscopy) 방법을 이용하여 삼차구조를 규명한 결과 나노포어 단백질 센서가 커피 드리퍼와 유사하게 입구가 넓은 깔때기 모양의 구조를 지니고 있음을 규명하였다.
○ 이와 같은 나노포어 단백질 센서의 독특한 구조와 강력한 표면전하 특성 덕분에 나노포어 내부에서 발생하는 전기삼투(electro-osmosis) 현상을 이용하여 나노포어를 통과하는 물 분자들의 흐름을 조절함으로써 한 번에 1개의 단백질 분자만을 검출할 수 있는 단일 분자 측정 기술을 개발하였다. 또한, 이러한 나노포어 센서를 통해 다양한 크기와 전하를 가지는 여러 단백질들(MDM2, Bcl-xL, FKBP12, holo-transferrin 등)을 대하여 모두 단일 분자 수준에서 측정이 가능함을 증명하였다.
○ 연구팀은 전기신호 분석과 분자동역학 시뮬레이션(molecular dynamics simulation) 실험을 통해서 상기 나노포어 센서에 표적 단백질을 첨가하였을 때 발생하는 독특한 전기적 신호패턴을 발견하였고, 이는 나노포어 내부에 포집된 표적 단백질의 움직임에 의한 것임을 확인하였다. 깔때기 구조의 비대칭성으로 인한 나노포어 내 이온밀도 구매는 포진된 표적 단백질의 움직임에 의한 전기적 신호 변화를 극대화할 수 있어 초고해상도의 정밀한 측정이 가능하였다.
○ 본 연구진은 나노포어 센서에 인가하는 전압의 세기 및 외부 환경요인을 조절해 전기신호 측정조건을 최적화한 결과, 항암 표적 단백질 BCA-xL이 저분자 약물(ABT-737, A-1331852)과 결합 시 전류 신호 변화(current amplitude)와 노이즈(noise) 신호 패턴이 현저하게 달라짐을 관찰하였다. 이를 통해 나노포어 센서를 이용하여 표적 단백질-약물 결합을 단일 분자 수준에서 초고감도로 모니터링할 수 있음을 증명하였다.
○ 기존의 표적 단백질-약물 결합 분석기술들은 조합 단위로 측정하여 평균한 신호를 분석하는 조합 평균(ensemble averaging) 방식의 한계를 가진 데 반해, 본 연구진이 개발한 나노포어 센서는 개별적인 단일 분자의 위치, 구조, 동역학, 상호작용 및 반응 등의 정밀한 측정이 가능하다. 이를 이용하면 초고속 약효 분석이 피코몰(picomole) 수준의 극미량 시료로도 가능하며 기존 약물 스크리닝 기술인 핵자기공명 분광법(NMR) 대비 시료량을 약 4,500배 절감할 수 있다.
○ 상기 나노포어 센서를 이용하여 세포사멸 억제 항암 표적 단백질 Bcl-xL 단독상태, Bcl-xL과 Bak-BH3의 단백질 복합체, 그리고 Bcl-xL과 ABT-737 약물의 복합체로부터의 전기신호 패턴이 현저히 다르게 나타남을 확인하였다. 이를 이용하여 Bcl-xL과 Bak-BH3의 단백질 복합체에 단백질 상호작용 저해제 ABT-737을 처리하였을 때, Bcl-xL/Bak-BH3 복합체 유래 전기신호 패턴이 감소함과 동시에 Bcl-xL/ABT-737 복합체 유래 전기신호 패턴이 증가함을 확인하였다. 이를 통해 동일한 표적 단백질에 결합하는 서로 다른 리간드 간 경쟁적 결합을 실시간 모니터링하고 정량적 분석을 통해 결합 친화도를 측정할 수 있었다.
○ 나아가, 표적 단백질-약물 결합 유래의 전기신호 변화를 활용하여 동일한 표적 단백질 Bcl-xL에 결합된 상이한 저분자 약물 ABT-737과 A-1331852를 민감하게 구분할 수 있는 초고해상도의 약물 지문(drug fingerprinting)’ 기술을 개발하였다. 이는 향후 단일 분자 수준에서 극미량 시료만으로도 약물의 구조-활성 관계(structure-activity relationship) 및 결합 자리 분석이 가능해 약물의 작용 메커니즘(mode of action) 규명에 활용할 수 있다.
□ 연구성과의 의미
○ 단일 분자 수준으로 측정 가능한 고효율 신약발굴 센서 개발
- 본 연구에서 표적 단백질-약물 결합을 단일 분자 수준에서 모니터링할 수 있는 초고감도의 신규 나노포어 센서 개발에 성공하였다. 이를 이용하면 극미량 신약 스크리닝이 가능해져, 향후 신약개발에 필요한 비용 및 시간을 절감하여 신약개발의 효율성 제고에 기여할 것으로 기대된다.
- 표적 단백질-약물 결합을 단일 분자 수준에서 모니터링하게 되면 신약후보 물질 발굴을 위한 초고속 약효 분석이 피코몰(picomole) 수준의 극미량 시료만으로도 가능해진다. 나노포어 센서는 기존 기술의 한계를 극복하여 기존 기술 대비 약 4,500배 시료량을 절감할 수 있다. 따라서 본 연구성과는 신약개발 과정에서 가장 많은 시간과 비용이 소요되는 약물 발굴 단계를 저비용/고효율화함으로써 신약개발의 효율성을 증진하는 데 크게 기여할 수 있을 것으로 기대된다.
○ 본 연구성과는 신약발굴용 새로운 나노포어 센서를 세계 최초로 개발한 사례로서, 본 연구진은 단백질 엔지니어링과 나노센서 기술을 융합하여 다양한 표적 단백질을 단일 분자 수준에서 검출할 수 있는 나노포어 센서를 단백질 소재로 제작하였다. 이는 향후 신약발굴과 질병 진단 목적으로 실용화될 수 있는 신규 센서 플랫폼을 마련하고 이의 특허출원을 통해 원천성을 선점했다는 점에서 커다란 의미가 있다.
○ 신약개발이 난이했던 표적들에 대해서도 새로운 신약개발 접근의 가능성 제시
- 현재 단백질-단백질 상호작용 등 신약개발이 난이했던 표적들(undruggable targets)과 낮은 용해도의 난용성 표적들(insoluble targets)의 경우 약물 탐색 기술 적용이 어려운 실정인데, 본 연구에서 단일 분자 수준으로 측정이 가능한 신규 나노포어 센서 개발을 통해 그동안 신약개발이 난이했던 표적들에 대해서도 새로운 신약개발 접근의 가능성이 기대된다.
- 본 연구에서는 새로운 초고감도 나노포어 센서를 개발하여 단백질-단백질 상호작용을 단일분자 수준에서 모니터링 하는 데 성공하였다. 최근 단백질-단백질 상호작용은 암을 비롯한 질환 치료의 유망한 표적으로 주목받고 있으나 이에 적용 가능한 효과적인 대용량 약물 스크리닝 기술 개발은 매우 어려운 상황인데 본 연구성과는 단백질-단백질 상호작용을 표적으로 한 기존 신약개발의 기술적 한계를 극복하였을 뿐 아니라 향후 단백질-단백질 상호작용 저해용 약물의 효과적인 발굴에 크게 기여할 것으로 예상된다.
연 구 결 과 문 답
이번 성과 뭐가 다른가
단백질 엔지니어링 기술을 통해 단일 분자로도 표적 단백질-약물 결합을 측정할 수 있는 고효율 신약발굴용 나노포어 센서를 세계 최초로 국내에서 개발한 사례이다.
어디에 쓸 수 있나
1. 단일 분자 수준의 표적 단백질-약물 결합 분석 통한 극미량, 초고감도 약물 스크리닝으로 저비용·고효율 신약발굴에 활용
2. 극미량 시료만으로 약물의 구조-활성 관계(structure-activity relationship, SAR)와 결합자리의 분석을 통해 약물의 작용 메커니즘 규명에 활용
3. 단백질-단백질 상호작용 표적, 낮은 용해도의 난용성 표적 등그 동안 신약개발이 난이했던 표적들(undruggable targets)의 약물 탐색에 활용
실용화까지 필요한 시간은
본 연구에서 개발한 나노포어 센서의 실용화를 위해서는 안정적인 나노포어 대용량 생산공정, 대용량 스크리닝(HTS) 시스템 개발 및 AI 기반 나노포어 데이터 분석기술 개발에 소요되는 시간에 따라 결정될 것으로 생각된다.
실용화를 위한 과제는
1. 나노포어 단백질 센서 및 멤브레인의 안정성 향상를 통한 센서 시스템의 안정성 확보
2. 대용량 약물 스크리닝을 실현하기 위한 multiarray 기반 HTS (high-throughput system) 개발
3. 표적 단백질-약물 결합 유래 전기신호를 신속하고 정확하게 판독 가능한 AI 분석기술의 개발
연구를 시작한 계기는
Oxford Nanopore technologies(ONT) 사를 필두로 한 나노포어 기반 염기서열 분석기술이 상용화에 성공하면서 나노포어 센서 기술의 혁신성을 발견할 수 있었음. 그러나, 아직까지 나노포어 기술로 단백질을 대상으로 한 신약발굴은 미개척된 태동기 연구영역이기 때문에 단백질 엔지니어링을 통해 새로운 구조의 나노포어 센서를 개발하여 기존 분석기술들의 기술적 한계를 돌파하고자 하였다.
에피소드가 있다면
나노포어 센서를 기반으로 항암표적 단백질-단백질 상호작용 저해용 소형분자 약물 개발 연구를 하던 중, 다양한 크기와 전하를 가진 많은 수의 단백질을 대상으로 신약을 스크리닝할 수 있는 기술이 필요하였다. 이 때 전기영동이 아닌 전기삼투원리를 융합하여 단백질의 표면전하의 제약없이 검출 가능한 새로운 고효율 신약발굴용 센서 시스템을 개발하게 되었다.
꼭 이루고 싶은 목표는
Oxford Nanopore technologies(ONT) 사는 나노포어 기반 DNA 시퀀싱 기술을 사업화하는 데 성공하였다. 초기에 시퀀싱 정확도가 50% 정도였음에도 불구하고 혁신적인 개선과 발전을 통해 현재 95% 이상의 정확도를 가진 센서를 개발하는 데 성공하였다. 이렇게 개발된 나노포어 시퀀서는 세계적으로 상용화되어 코로나19 RNA 전사체 규명 등에 널리 기여한 바 있다. 본 연구진이 개발하고 있는 나노포어 센서 기반 신약 스크리닝 기술도 실용화를 통해 인류에 필요한 신약개발을 가속화하는 데 기여할 수 있는 기술로 발전시키는 것이 목표다.
신진연구자를 위한 한마디
본 연구성과는 나노포어 센서 기반 단일 분자 분석기술을 이용하여 표적 단백질-약물 결합을 효율적으로 발굴하는 나노바이오 융합연구 성과이다. 다학제간 깊이 있는 전문성이 융합되어 미개척된 새로운 분야를 만들고 이를 발전시켜나간 것이 이 연구성과 창출의 주된 원동력이 될 수 있었다고 생각한다. 당장 어렵더라도 도전하는 연구목표를 달성하기 위해 새로운 융합분야까지 확대하여 연구개발에 임한다면 결국에는 좋은 결실을 얻을 수 있을 것으로 생각한다.

그림1. 단일 분자 수준으로 표적 단백질-약물 결합 측정 가능한 새로운 나노포어 센서 개발
단일 분자 수준에서 표적 단백질-약물 결합 측정이 가능한 고효율 신약발굴용 나노포어 센서 개발

그림2. 신규 나노포어 센서 단백질의 삼차 구조 및 나노유체 특성
강력한 전기삼투(electroosmotic flow) 현상을 발생시키는 나노포어 단백질 센서의 나노유체학적 특성을 연구
a. 나노포어 단백질의 깔때기 구조 및 표면특성
b. 나노포어 단백질의 커피 드리퍼(coffee dripper) 모양의 구조
c. 나노포어 단백질의 표면전하 밀도 분석도
d. 나노포어를 통과하는 물 분자의 유량 시뮬레이션 분석도

그림 3. 나노포어 센서를 이용한 단일 분자 표적 단백질의 분석
입구가 넓은 깔때기와 유사한 나노포어 단백질의 구조와 나노포어 내 강력한 전기삼투 현상에 의해 다양한 크기(12.3 kDa–77.1 kDa) 및 표면전하(pI 5.3 - 9.6)의 단일 분자 단백질들을 포집하여 전기신호를 관찰하였음. 이는 나노포어 내부에서 표적 단백질이 에너지 최소점(energy minima) 간을 이동하며 발생하는 전류차단 변화에 따라 유도된 고유의 전기신호 패턴임.
a. 나노포어 센서에서 단일분자 단백질의 전류패턴 유발 단계 (포획, 포집, 이탈)
b. 나노포어 센서로 측정한 단일 분자 단백질의 고유한 전류패턴
c. 나노포어 내 단백질 위치 시뮬레이션
d. 나노포어 내 단백질 위치에 따른 자유에너지 변동
e. Holo-transferrin (77.1 kDa, pI 6.8) 단백질의 전압별 전류패턴
f. Bcl-xL (20.8 kDa, pI 5.3) 단백질의 전압별 전류패턴
g. FKBP12 (13.0 kDa, pI 8.0) 단백질의 전압별 전류패턴
h. MDM2 (12.3 kDa, pI 9.6) 단백질의 전압별 전류패턴
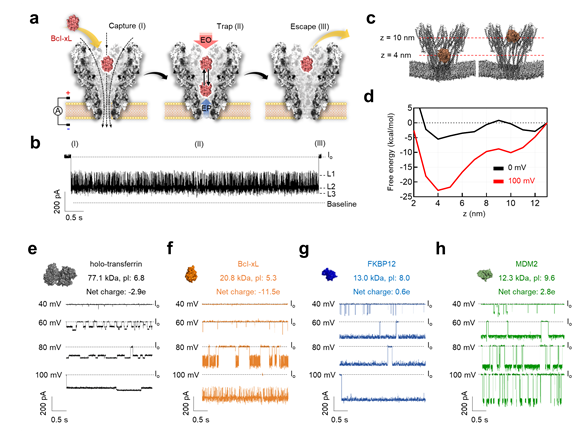
그림 4. 나노포어 센서를 이용한 노이즈 신호 기반 표적 단백질-리간드 결합 분석
표적 단백질 Bcl-xL에 펩타이드(Bak-BH3)와 저분자 약물(ABT-737)을 각각 반응시켰을 때 기존의 Bcl-xL 유래 전류패턴이 현저히 변하는 것을 확인하였음. 이를 통해 나노포어 센서를 이용해 단일 분자 표적 단백질에 펩타이드 및 저분자 약물이 결합하는 것을 분명하게 검출할 수 있었음. 나아가 일련의 전류패턴 필터링 방법을 통해 리간드 결합신호를 펩타이드의 경우 4.8 배, 저분자 약물의 경우 1.7 배 향상할 수 있었음.
a. Bcl-xL, Bcl-xL+Bak-BH3(펩타이드), Bcl-xL+ABT-737(저분자 약물) 유래 전류패턴
b. 주파수 필터링 조건에 따른 각 검체의 전류패턴 분석

그림 5. 나노포어 센서를 이용한 표적 단백질-저분자 약물 결합 분석
표적 단백질에 음성대조군을 반응시켰을 때는 전류패턴의 변화가 없었던 반면, 표적 약물의 경우 현저한 전류패턴의 변화가 관찰되었으며, 나아가 표적 단백질을 약물 혼합액과 반응시켰을 때에도 각각의 표적 약물들의 결합을 구분해 낼 수 있었음. 이를 통해 본 연구진이 개발한 나노포어 센서는 동일한 표적 단백질에 결합하는 다양한 저분자 약물들을 민감하게 구분해낼 수 있었고, 이는 표적 단백질-약물 결합 분석에 있어 ‘단일 분자 지문(single-molecule fingerprinting)’의 개념을 최초로 증명하였음.
a. 음성대조군(LCL-161, GDC-0152) 및 표적 약물(ABT-737, A-1331852)을 Bcl-xL에 독립적으로 반응시켰을 때 Bcl-xL의 전류패턴 결과
b. Bcl-xL과 약물들을 독립적으로 반응시킨 후 측정한 전류패턴을 2D 밀도(전류 vs. 노이즈) 분석한 결과

그림 6. 나노포어 센서를 이용한 Bcl-xL 표적 단백질에 대한 약물의 경쟁적 결합 분석
표적 단백질에 펩타이드가 결합된 상태에서, 새로 첨가한 저분자 약물이 기존의 펩타이드를 해리시키고 경쟁적으로 결합되는 현상을 확인하였음. 이를 통해, 단일 분자 수준에서 약물의 ‘구조-활성 관계 분석(SAR-by-nanopore)‘의 가능성을 확인하고, 약물의 표적 단백질 결합 부위 발굴도 가능함을 보여주었음.
a. Bcl-xL에 대한 저분자 약물 간 경쟁적 결합 모식도
b. Bcl-xL+Bak-BK3(펩타이드)에 저분자 약물(ABT-737) 첨가 시 전류패턴 변화
c. ABT-737 첨가 후 시간에 따른 2D 밀도(전류 vs. 노이즈) 분석
d. Bcl-xL+저분자 약물(ABT-737)에 저분자 약물(A-1331852) 첨가 시 전류패턴 변화
e. A-1331852 첨가 후 시간에 따른 2D 밀도(전류 vs. 노이즈) 분석
생명과학 한국생명공학연구원 (2023-04-12)