게놈 안정화를 조절하는 새로운 경로 규명
국내 연구진이 게놈 안정화를 통해 DNA 돌연변이를 억제하는 세포 내 방어 시스템을 발견하였다.
※ 게놈(Genome) : 생물이 가지는 모든 유전자 물질이며, DNA로 구성된 유전 정보를 지칭
한국연구재단은 조선대학교 유호진 교수 연구팀이 DNA 손상을 복구하여 게놈 안정화를 유지시키는 새로운 경로를 규명했다고 밝혔다.
생명체에 필요한 유전정보를 담고 있는 DNA가 외부 유해인자 또는 복제 과정 중에 손상되어 게놈 불안정성이 유발되면 암 발병, 암 악성화 촉진 및 항암제 내성 등을 유발하기 때문에 손상된 DNA를 정상화하는 과정은 암을 포함한 각종 질병 억제에 필수적이다.
게놈 안정화를 유지시키는 경로에 대한 연구는 매우 활발하게 진행되고 있으며, 지난 2015년에는 손상된 DNA의 복구 단백질을 규명한 3명의 과학자가 노벨화학상을 수상했다.
하지만, 게놈 안정화 과정 중 DNA의 손상 부위를 정확히 인지하고 복구하도록 지시하는 구체적 과정은 아직 알려지지 않았다.
연구팀은 DNA 손상을 인지하는 53BP1 단백질과 DNA 손상을 복구 시키는 RAD51 단백질이 게놈 안정화 유지를 위하여 어떻게 작용하는지에 대한 메커니즘을 새롭게 규명했다.
※ 53BP1, RAD51 : 핵 속에 존재하는 단백질로, DNA 손상 후 DNA 복구에 관여함.
DNA가 복제될 때 53BP1이 히스톤의 합성을 촉진, 복제된 DNA가 정상적으로 포장되고 게놈 안정화를 유지시킨다는 사실을 밝혔다.
※ 히스톤 : 진핵생물의 DNA에 결합되어있는 단백질로 게놈의 구조를 유지함.
또한, 연구팀은 유해인자에 의하여 DNA가 절단되었을 때 RAD51에 수모(SUMO)가 발생되어 절단된 부위를 신속하게 복구시켜 게놈 안정화를 유지시킨다는 사실도 확인했다.
※ 수모(SUMO) : 단백질 기능을 수정하기 위해 세포의 다른 단백질에 결합하는 작은 단백질 군
이에 연구팀은 게놈 안정성 조절 단백질의 작용 메커니즘 규명을 통하여 DNA가 돌연변이로 변질되기 전에 정상화 시키는 과정을 구체적으로 밝힌 것이다.
나아가, 게놈 불안정성 제어를 통한 암 발병, 암 전이, 암 치료 내성 발생 등을 극복하는 치료제 개발의 실마리를 제공할 수 있게 되었다.
연구팀은 새롭게 발견된 게놈 안정화 경로와 활성조절 인자를 이용하여 암 발병 및 진행을 억제하는 약물 개발을 추진 할 예정이다.
과학기술정보통신부와 한국연구재단이 추진하는 선도연구센터사업의 지원으로 수행된 이번 연구의 성과는 국제학술지 ‘뉴클레익 액시드 리서치(Nucleic Acids Research)’에 1월 17일, 21일 두 편의 논문으로 게재되었다.
주요내용 설명
<작성 : 조선대학교 유호진 교수>
논문명
53BP1-ACLY-SLBP-coordinated activation of replication-dependent histone biogenesis maintains genomic integrity(https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkab1300/6509083)
저널명
Nucleic Acids Research
키워드
53BP1(53 비피원), genomic integrity(게놈 보존), histone(히스톤), replication(복제), DNA repair (DNA 복구), cancer (암)
DOI
10.1093/nar/gkab1300
저 자
유호진 교수(교신저자/조선대학교), 오정정(Ting Ting Wu) 박사(공동 제1저자/조선대학교),
전세모 박사(공동 제1저자/조선대학교), 최은지(조선대학교), 양은비(조선대학교), 이현서(조선대학교), 김상용(조선대학교 병원), 나미아 아메드 파미(Naima Ahmed Fahmi, University of Central Florida), 퀴빙 지앙(Qibing Jiang, University of Central Florida), 웨이 장(Wei Zhang, University of Central Florida), 용정식(University of Minnesota Twin Cities), 이정희(조선대학교)
1. 연구의 필요성
○ DNA는 세포분열 때 복제되는데, 이 과정에서 쉽게 손상 된다. 또한 세포내외의 다양한 유해인자들에 의하여 DNA 손상이 흔하게 발생된다. 이들 DNA 손상은 정상화 되지 못하면 게놈 불안정성을 유발하는 데, 이는 암 발병에 중요한 원인이다.
○ 실제, 고형 종양의 80% 이상이 심각한 게놈 불안정성을 보이고, 게놈 불안정성이 높을수록 암 진행 과정 세포는 진화하면서 악성 표현형을 획득한다. 따라서 악성 암은 단일종양 내 또는 종양간의 유전적 다양성이 매우 높아 종양 이질성을 초래하여 암 치료 실패의 주요 원인이 된다. 이의 해결이 오늘날 암을 치료하기 위한 가장 큰 도전이며, 암 정복의 핵심 관건이다. 따라서 게놈 안정성을 유지하는 조절 메커니즘을 명확히 알아내는 것은 악성 암 치료방법을 개발하는데 필수적이다.
○ DNA에 손상이 발생하면 DNA 손상반응에 관여하는 단백질들이 이를 인지하고 세포내 신호를 활성화하여 게놈 안정성을 유지한다. DNA 손상반응에 관여하는 대표적인 핵 내 단백질인 53BP1과 DNA 복구단백질인 RAD51은 게놈 안정성 유지에 중요한 역할을 한다고 알려져 있으나 아직 구체적인 메커니즘은 정확하게 밝혀지지 않았다.
2. 연구내용
○ 53BP1은 DNA를 감싸는 히스톤 합성에 중요한 SLBP 유전자 발현을 증가시켜 DNA 복제과정을 정교하게 수행하고, DNA손상 시 정상적으로 복제가 진행될 수 있게 하는 중요한 역할을 수행한다는 새로운 사실을 밝혔다.
※ SLBP : 히스톤 합성에 중요한 단백질
○ 53BP1은 히스톤 아세틸화에 관여하는 ACLY 활성을 증가시켜 SLBP의 유전자 발현을 조절하여 복제에 필수적인 히스톤 공급을 한다는 구체적인 메커니즘을 규명하였다. 아울러 세포내에 ACLY 또는 SLBP가 결핍되면, 복제 과정이 정상적으로 진행되지 못하여 게놈 불안정성이 증가된다는 사실 또한 확인하였다.
※ ACLY : Acetyl-CoA를 생성하는 효소. 핵 내에서 아세틸기를 공급하여 후성유전학적으로 유전자 발현을 조절
○ 또 본 연구에서는 DNA 손상이 발생하였을 때 TOPORS의 인산화가 발생하여 RAD51과 결합하고 그 결과 RAD51의 단백질 변형이 발생하여 DNA 복구 활성을 조절하고 게놈 안정성을 유지한다는 새로운 사실을 규명하였다.
※ TOPORS : 단백질에 수모(SUMO)를 부착하여 기능을 변화시키는 단백질
○ 본 연구결과로 밝혀진 게놈 안정성을 조절하는 새로운 경로는 복제과정과 다양한 유해인자들에 의하여 유발된 DNA 손상을 세포가 어떻게 정상화 시키는지에 대한 정확한 메커니즘을 설명할 수 있다.
3. 연구성과/기대효과
○ 세포가 복제 과정에서 발생하는 오류를 교정하고 정상화시키는 조절인자들의 규명과 더불어, 빠르게 분열하는 세포의 게놈을 손상으로부터 보호하고 안정화 시키는 지를 처음으로 밝혔다.
○ 본 연구에서 밝혀진 게놈 안정성 조절 단백질의 작용 메커니즘을 통하여 DNA 돌연변이를 억제하는 새로운 방법들을 이해하는데 기여 할 수 있게 되었고, 게놈 불안정성 억제를 통한 암 발병 및 암 악성화 억제기술을 통하여 악성암 치료 가능성을 제시할 수 있게 되었다.

(그림1) DNA 복제과정에서 히스톤을 생성하여 게놈안정화를 유지하는 메커니즘
- DNA 복제가 발생하면 53BP1이 ACLY에 결합하여 SLBP의 발현을 증가시키고, 증가된 SLBP가 히스톤 합성을 촉진하여 DNA를 정상적으로 포장한다.
- 만약 이 경로에 문제가 발생하면 세포분열 도중 포장되지 않는 DNA가 생성되어 게놈 불안정성이 발생된다.
그림설명 및 그림제공 : 조선대학교 유호진 교수
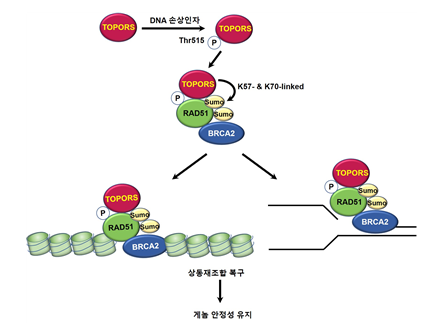
(그림2) 손상된 DNA를 정상화시키는 메커니즘
- DNA 손상이 발생되면 TOPORS 단백질의 인산화가 손상초기에 발생하고 인산화된 TOPORS가 RAD51과 결합한 후 RAD51에 수모(SUMO)가 부착된다.
- 수모가 부착된 RAD51이 BRCA2와 결합하여 손상된 부위로 이동된 후 손상된 DNA를 복구시킨다.
- 세포에 TOPORS가 결핍되면 RAD51 단백질들이 손상된 부위로 이동하지 못하여 DNA 돌연변이가 발생되어 게놈 불안정성이 초래된다.
그림설명 및 그림제공 : 조선대학교 유호진 교수
연구 이야기
<작성 : 조선대학교 유호진 교수>
□ 연구를 시작한 계기나 배경은?
53BP1과 RAD51은 DNA 손상을 억제하여 게놈 안전성을 유지하는데 중요한 역할을 하는 단백질들이다. 하지만 53BP1과 RAD51에 의하여 게놈 안정성을 유지하는 정확한 메커니즘과 경로들에 대해서는 알려지지 않아서, 그 정확한 조절 메커니즘을 밝히기 위하여 연구를 시작하였다.
□ 연구 전개 과정에 대한 소개
연구 대상인 53BP1과 RAD51에 결합하는 단백질들 중 하나가 게놈 안정화에 중요한 작용을 할 가능성이 있을 것으로 생각하고, 53BP1과 RAD51에 결합하는 단백질들을 밝히는 연구를 수행하였다. 그 결과 기존에 밝혀지지 않은 결합단백질들이 발굴되었는데, 이들 중 히스톤 아세틸화를 통하여 유전자를 조절하는 단백질인 ACLY와 수모변형을 통하여 단백질 활성을 조절하는 TOPOTRS 단백질들을 발굴하고 그 기능을 검증하였다.
□ 연구하면서 어려웠던 점이나 장애요소는 무엇인지? 어떻게 극복(해결)하였는지?
53BP1이 후성유전체학으로 조절하는 유전자들 중에서 히스톤 합성에 관여하는 유전자를 규명하는데 어려움이 있었다. 유전체 분석을 통하여 히스톤대사에 관여하는 단백질인 SLBP가 표적임을 규명하는데 성공하였다.
또한, RAD51이 수모를 유발하는 TOPORS와 어떻게 결합하는지 규명하는데 어려움이 있었다. 변형된 단백질 부위 분석을 통하여 DNA 손상이 발생하면 TOPORS의 특정부위에 인산화가 발생되어 RAD51과 결합한다는 사실을 규명하였다.
□ 이번 성과, 무엇이 다른가?
기존에 정확하게 이해하기 힘들었던 게놈 안정화 메커니즘을 규명함으로써 DNA 돌연변이를 억제하는 세포내 방어 시스템을 규명하였다는 점에서 의의가 크다고 하겠다.
□ 실용화된다면 어떻게 활용될 수 있나? 실용화를 위한 과제는?
53BP1과 RAD51에 의한 게놈 안정성 조절에 관여하는 경로와 결합 단백질의 활성을 제어하는 물질개발을 통하여 암 발병 및 암 악성화 억제기술을 개발할 수 있다.
□ 꼭 이루고 싶은 목표나 후속 연구계획은?
후속 연구를 통하여 악성 암 치료제를 개발할 예정이다.
생명과학 한국연구재단 (2022-01-27)